O conjunto de valores das propriedades termodinâmicas de um sistema se denomina estado termodinâmico, ou, simplesmente, estado do sistema. O estado termodinâmico de um tanque de gás , por exemplo, será determinado indicando-se sua temperatura (ºC), o seu volume (L), o número de moléculas ou número de mols (1mols). Para se chegar a um estado termodinâmico (ou estado do sistema) é necessário obter o conjunto de valores das propriedades termodinâmicas.
Quando se indica a temperatura, o volume, o número de moléculas ou mols, tem-se o estado termodinâmico, por exemplo, de uma porção de gás. As funções de estado dos sistemas termodinâmicos geralmente têm uma certa interdependência. Na equação de estado de um gás ideal, duas das funções de estado podem ser arbitrariamente selecionadas como variáveis independentes, e outras grandezas estatísticas são consideradas como suas funções.
Um fato importante de falarmos nesse tema, é que está intimamente ligado ao trabalho de uma força, bem como a temperatura, volume e energia interna de um gás perfeito. No estudo da termodinâmica temos que, para um determinado gás , podemos calcular o trabalho da força exercida por ele. Para isso, vamos imaginar um vaso com um êmbolo.
Por exemplo, um gás pode ter seu estado termodinâmico modificado de diversas maneiras dependeendo do tipo de parede que delimita o recipiente que encerra o gás. Se as paredes forem rígidas mas permitirem a troca de calor, paredes diatérmicas, o estado do gás poderá ser modificado simplesmente pelo contato do recipiente mais quente. A relação matemática entre as variáveis de estado designa-se por equação de estado , a qual permite prever o comportamento do sistema face à alteração de uma ou mais variáveis de estado. Qualquer equação que apresente uma relação entre as variáveis de estado de um gás é denominada equação de estado do gás. A equação de estado do gás perfeito ou ideal é conhecida como equação de Clapeyron, em homenagem a Benoit Paul Émile Clapeyron que, em meio a muitos outros resultados importantes, escreveu tal equação como.
NPwx Stoodi é um canal com video aulas de reforço escolar e preparação para. A abordagem através de estados de equilíbrio termodinâmico do sistema requer um relato completo do estado do sistema, bem como a noção de processo a partir de um estado para outro de um sistema, mas pode necessitar de apenas uma conta idealizada ou parcial, do estado do entorno do sistema ou de outros sistemas. Dá-se também o nome de função de estado às variáveis de estado que são assumidas dependentes de outras – geralmente daquelas escolhidas para definir-se o estado.
Em um sistema fechado, o gás ideal pressupõe um comportamento que envolve as seguintes grandezas físicas: pressão, volume e temperatura. Essas variáveis definem o estado termodinâmico de um gás. Comportamento dos gases segundo as leis dos gases.
A pressão (p) é produzida pelo movimento das partículas do gás dentro do recipiente. Esta equação de estado possibilita descrever o comportamento de um gás ideal, com base no conhecimento da sua pressão, volume ou temperatura. Um gás ideal é constituído por partículas sem volume e onde não existem forças de interacção entre elas, e por isso, o conceito de gás ideal é uma aproximação de um gás real. Cuidado: gás ideal é uma substância idealizada!
Os gases reais se comportam como gás ideal a baixas pressões e altas temperaturas. Quando estudamos um gás , temos que estudar suas três grandezas fundamentais: pressão, volume e temperatura. Essas grandezas são chamadas de variáveis de estado dos gases porque elas influenciam grandemente suas propriedades e comportamento.
Assim por exemplo, quanto maior a quantidade de ar que está sobre um líquido, maior será a pressão. Um sistema termodinâmico ao passar de um estado inicial para um estado final, tem 200J de trabalho realizado sobre ele, liberando 70cal. D) As variáveis de estado de um gás são: massa, volume e número de moléculas. Um cilindro de oxigênio hospitalar (O 2), de litros, contém, inicialmente, gás a uma pressão de 1atm e temperatura de 3K. O gás se expande isotermicamente ao receber 4J de calor do meio exterior.
K, determine: a) O número de mols do gás que sofre o processo. K, ocupando um volume de m. Exercícios 7- Trabalho e Primeira Lei da Termodinâmica. Mediante um processo isobárico, o gás é submetido à transformação indicada no gráfico. Vamos imaginar um gás contido dentro de um cilindro com um êmbolo móvel, sem peso e sem atrito, para um dado volume, a uma certa pressão e temperatura.
Um sistema fechado é aquele em que somente a energia transpõe os limites do sistema, enquanto no aberto, tanto a energia quanto uma certa quantidade de matéria transpões os limites. Este será descrito pelo conjunto de. Un estado termodinámico es el conjunto de los valores que toman las propiedades de un sistema termodinámico que deben ser especificadas para reproducir el sistema. Los parámetros individuales son conocidos como variables de estado , parámetros de estado o variables termodinámicas.
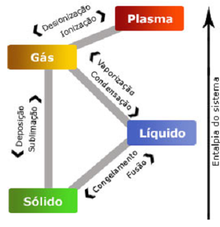
En termodinmica, se dice que un sistema se encuentra en estado de equilibrio termodinmico, si es incapaz de experimentar espontneamente algn cambio de estado o proceso termodinmico cuando est sometido a unas determinadas condiciones de contorno, (las condiciones que le imponen sus alrededores). Estado termodinamico , equilibrio. Uma modificação gasosa ocorre quando pelo menos duas variáveis de estado são modificadas. Transformações de um gás : com temperatura constante e com pressão constante. Dentro de um contentor cilíndrico, que possui um êmbolo móvel, aprisiona-se uma certa quantidade de gás.
Inicialmente, no estado o gás. Se o volume do gás se mantém constante, não há trocas de trabalho com o meio externo. Gas Sistema “ Um sistema é uma região do espaço ou quantidade de matéria a ser estudada.
O exemplo apresentado aqui é um sistema fechado (uma quantidade fixa de matéria). SYSTEM Boundary tipos de sistema. O calor não pode fluir, de forma espontânea, de um corpo de temperatura menor, para um outro corpo de temperatura mais alta.