
Regra do octeto: A partir da observação dos gases nobres que possuem elétrons em sua última camada (com exceção do Hélio que possui elétrons), formulou-se a regra de que os átomos se. Um certo número de elementos adquire estabilidade eletrônica quando seus átomos apresentam oito elétrons na sua camada mais externa, e usualmente esses se ligam de forma a buscarem completar esses oito elétrons, especificamente ao completar suas camadas externas. Achar o átomo central (não pode ser H nem O). Escrever os oxigênios ao redor do átomo central. As ligações iônicas, geralmente estabelecida entre um metal e um ametal (não metal), formam os compostos iônicos: elementos sólidos, duros e quebradiços que apresentam alto pontos de fusão e ebulição, além de conduzirem corrente elétrica quando dissolvidas em água.
Para saber mais sobre o cursinho pré-vestibular mais forte e completo para o Enem e principais vestibulares, que adota uma metodologia exclusiva com Estudo O. Ao nosso redor vemos uma grande diversidade de substâncias. Elas se diferenciam por muitos aspectos, como cor, estado físico (sólido, líquido e gasoso), cheiro, sabor, capacidade de entrar em combustão, pontos de fusão e ebulição, densidade etc. Conheça também nosso Site.
Confira o vídeo e se não entender alguma coisa. Os átomos dificilmente ficam sozinhos na natureza. Eles tendem a se unir uns aos outros, formando assim tudo o que existe hoje.
Alguns átomos são estáveis, ou seja, pouco reativos. Basicamente, duas forças de naturezas distintas atuam no interior da matéria: são as forças intermoleculares, isto é, entre moléculas, e as forças intramoleculares, que agem no interior dessas moléculas, entre dois ou mais átomos. As outras formas de interação entre átomos são a ligação covalente, que ocorre entre átomos de ametais, hidrogênios, ou ametal e hidrogênio, e a ligação metálica, a qual acontece somente entre átomos de um mesmo metal. Aula sobre ligações químicas Slideshare uses cookies to improve functionality and performance, and to provide you with relevant advertising.
If you continue browsing the site, you agree to the use of cookies on this website. Se aproximarmos dois átomos de forte eletronegatividade, um não terá força para capturar o elétron do outro permanentemente. Ele captura o elétron mas o outro consegue capturá-lo de volta e, além de retomá-lo, captura um elétron do outro. Ressonância de Hoyle: 8Be no estado fundamental tem a mesma energia de duas partículas alpha.
Veja as aplicações, propriedades e exemplos de ligas metálicas, isto é, misturas de substâncias cujo componente principal é um metal. Polaridade das ligações. Geralmente, acontece em moléculas de átomos diferentes. Se o valor for maior que a ligação é iônica.
O átomo A perde elétron e transforma-se em um íon (cátion) monovalente. Dê exemplos de íons que possuem este tipo de configuração eletrônica. São conhecidos na natureza pouco mais de 1elementos. Porém, já foram caracterizados cerca de milhões de compostos químicos. Estes compostos são formados por combinações específicas de átomos de elementos diferentes, ou seja, átomos se unem para formar compostos com propriedades específicas ou moléculas.
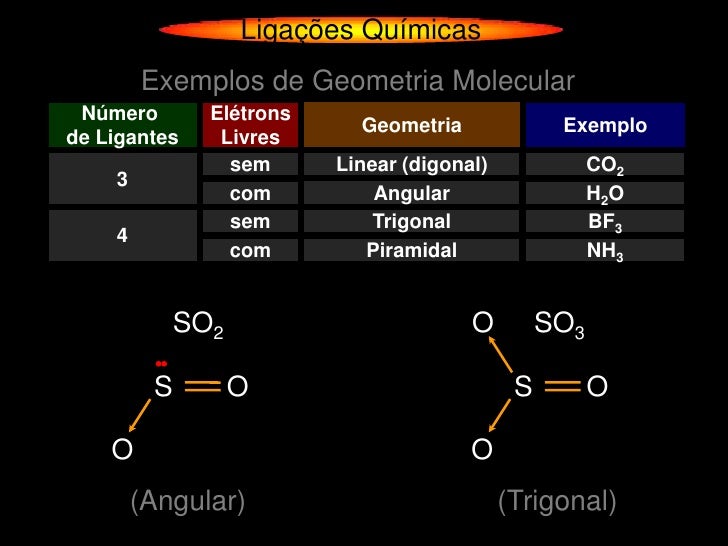
São através dessas ligações que os átomos se unem e formam todos os compostos presentes no universo, seja um sal como o NaCl, um carboidrato ou até mesmo uma proteína. A ligação de hidrogênio vai ocorrer via o par de elétrons não ligantes do oxigênio da molécula de éter. A) Nas ligações metálicas há compartilhamento de pares eletrônicos. Os metais são maleáveis e dúcteis. B) As ligações covalentes são predominantemente realizadas entre elementos os mais afastados possíveis na Tabela Periódica, ou seja, com tendência não muito diferente de atração pelo elétron de ligação.
Agora vejamos outro tipo de fórmula química mais simples que a fórmula eletrônica: a fórmula estrutural plana. Existem três tipos principais de ligações químicas: iônica, covalente e metálica. Os sólidos iônicos estão unidos por causa da forte atração entre seus íons cátions e seus íons ânions.
A maioria dos metais são sólidos à temperatura ambiente por causa da ligação metálica. Nos exemplos abaixo, identifique quais as ligações químicas presentes nas substâncias. Deixe as respostas nos comentários, ok?
De forma resumida, apresento o quadro abaixo no qual você poderá ver como são formadas as ligações químicas covalente, iônica e metálica. Chegamos ao final de mais um artigo. Ligações Químicas – Resumo.
Posts about exemplos de ligações quimicas written by anarosaklinke. No nosso cotidiano, há muitas reações químicas envolvidas, como por exemplo, no preparo de alimentos, a própria digestão destes alimentos no nosso organismo, a combustão nos automóveis, o aparecimento da ferrugem, a fabricação de remédios, etc. Exemplos de ligação iônica. Informações sobre propriedades e usos de alguns compostos iônicos: ANEXO 1. Você recortou seu primeiro slide!
Recortar slides é uma maneira fácil de colecionar slides importantes para acessar mais tarde. Agora, personalize o nome do seu painel de recortes. Quando o compartilhamento é feito dessa forma, dizemos que ocorreu uma ligação covalente comum. Observe agora o caso do monóxido de carbono (CO): Note que há duas ligações covalentes comuns e uma outra representada por uma seta.

As ligas não ferrosas são as que não apresentam o ferro como principal constituinte. Alguns exemplos : Latão: liga de zinco e cobre. São resistentes à corrosão, inclusive à água do mar. Cátions e ânions são tipos de íons, ou seja, átomos que ganharam ou perderam elétrons através de ligações químicas.
Um átomo que possui o mesmo número de prótons (carga positiva) e elétrons (carga negativa) é considerado eletricamente neutro.