Un proceso termodinámico es la evolución de determinadas magnitudes termodinámicas relativas a un determinado sistema termodinámico. Estas transformaciones deben transcurrir desde un estado de equilibrio inicial a otro final. En física, se denomina proceso termodinámico a la evolución de determinadas magnitudes (o propiedades) propiamente termodinámicas relativas a un determinado sistema termodinámico.
Neste vídeo apresento os processos termodinâmicos isotérmicos, isocóricos, isobáricos e adiabáticos segundo a primeira lei da Termodinâmica. Fica o desafio da Expansão Livre como uma. Se um processo qualquer – geralmente processos bruscos, como a expansão livre – implicar em aumento da entropia do sistema, o estado inicial – de menor entropia – torna-se inacessível ao sistema sem violação da restrição imposta. Após uma expansão livre não se consegue mais retornar às mesmas condições de pressão, volume e. Na prática, nenhum processo é verdadeiramente um processo adiabático. Muitos processos dependem de uma grande diferença nas escalas de tempo do processo de interesse e da taxa de dissipação de energia térmica através de um limite do sistema e, portanto, aproximando-se usando uma suposição adiabática.
Processos irreversíveis. Na termodinâmica o processo irreversível refere-se a propriedade de um sistema de sofrer alterações que as leve de um estado inicial A para um estado final B, contudo de modo que torne-se impossível o retorno ao estado inicial, mesmo cambiadas as causas da transição inicial. A trajetória entre os estados define-se como o processo. Então temos o processo AB, BC, CD e DA. O processo é irreversível, isto é, de forma espontânea não é possível observar o processo inverso, em que a tinta misturada com toda a água, voltaria a formar uma gota.
No entanto, este processo não é espontâneo: faz-se necessária uma quantidade de energia externa, que ocorre na forma de trabalho, para que esta transferência seja possível. Num processo isobárico poderá acontecer troca de energia tanto em forma de calor como em forma de trabalho. Por exemplo, absorve calor e recebe trabalho do ambiente, e acontece um aumento do volume, sem que aconteça variação da pressão.
Durante o primeiro processo , Btu de calor são transferidos para o sistema, enquanto o sistema realiza Btu de trabalho. Durante o segundo processo , Btu de trabalho são realizados sobre o sistema. Esses conhecimentos se aplicam atualmente em várias situações do nosso cotidiano.
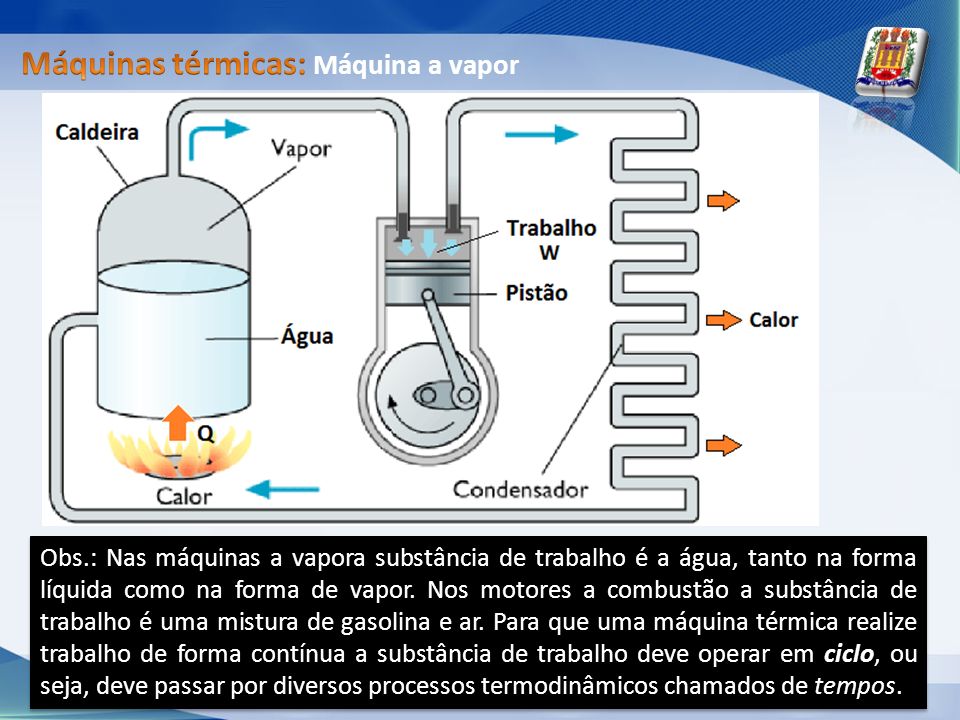
Por exemplo: máquinas térmicas e refrigeradores, motores de carros e processos de transformação de minérios e derivados do petróleo. As leis fundamentais da termodinâmica regem o modo como o calor se transforma em trabalho e vice-versa. Ciclo (ou processo cíclico) é definido como um sistema que sofre diversas transformações de estado e processos , no qual os valores iniciais e finais têm o mesmo valor. Um ciclo termodinâmico sofre processos e mudanças de estados em seu volume, pressão e temperatura. O motor de combustão interna é uma máquina térmica, que transforma a energia proveniente de uma reacção química em energia mecânica.
O processo de conversão dá-se através de ciclos termodinâmicos que envolvem expansão, compressão e mudança de temperatura de gases. O processo inverso, ou seja, transformar o calor em trabalho não é tão simples e está sujeito a certas restrições. Dessas restrições veio a segunda lei da termodinâmica que pode ser enunciada da seguinte forma: Não é possível construir uma máquina térmica que transforme integralmente o calor em trabalho. O segundo princípio regula a direcção em que são levados a cabo os processos termodinâmicos e impõe a impossibilidade de se desenvolverem em sentido contrário.
Convém destacar que esta segunda lei se apoia na entropia, uma grandeza física encarregue de medir a parte da energia que não pode ser usada para produzir trabalho. Un proceso adiabático es un proceso termodinámico en el que el sistema no intercambia calor con su entorno. Si el proceso es irreversible se llama procesio adiabático isentrópico. El calentamiento y enfriamiento adiabático son procesos que comúnmente ocurren debido al cambio en la presión de un gas. Esto puede ser cuantificado usando la ley de los gases ideales.
A transformação isotérmica é aquela em que, num processo termodinâmico de um gás ideal, a temperatura permanece constante durante o processo. Essa transformação também recebe o nome de Lei de Boyle-Mariotte. Termodinamicos Fisioquimicos Dichas magnitudes deben tener bien definidos los estados inicial y final, estudiándose el paso de uno a otro para saber la transformacion,cambio u evolucion.
Relaciones P, V, T en la expansión adiabática del gas ideal. Joule, en su célebre experimento sobre expansión libre, demostró que la energía interna de un gas perfecto era independiente del volumen (V), o la presión (P), sólo función de la temperatura. A thermodynamic process is the evolution of certain properties, which are called thermodynamic properties, in relation to a particular thermodynamic system. No possvel um processo no qual a entropia decresce. Um processo isotérmico reversível, no qual calor é transferido para ou do reservatório a alta temperatura 2. Um processo adiabático reversível, no qual a temperatura do fluido de trabalho diminui desde a do reservatório de alta temperatura até a do outro reservatório 3. O sinal de igual aplica-se apenas a processos reversíveis, em equiíbrio.
Se um processo aumenta a entropia do sistema isolado, o processo inverso está vedado, pois levaria a uma diminuição da entropia, o que não é permitido, segundo essa lei. Consequentemente, um processo que aumente a entropia do sistema isolado é irreversível. Assim, durante o dia, numa região litorânea, a areia se aquece mais do que a água do mar.
O ar aquecido acima da areia sobe e produz uma região de baixa pressão, aspirando o ar sobre o mar. Explique por que à noite o processo se inverte, isto é, sopra a brisa terrestre? Se o processo é irreversível, a entropia de um sistema fechado sempre aumenta.
No entanto, se o processo for reversível, como no caso da figura ao lado, seria possível reverter o processo recolocando esferas no pistão e, para que a temperatura não aumentasse, o gás cede calor para o reservatório, e a entropia diminui.