Observe a figura a seguir: A figura mostra um cilindro com gás em seu interior que está sendo submetido a uma variação de temperatura. O cilindro da figura contém uma massa de gás ideal. Considere um gás de massa m contido em um cilindro com área de base A, provido de um êmbolo.
Ao ser fornecida uma quantidade de calor Q ao sistema, este sofrerá uma expansão, sob pressão constante, como é garantido pela Lei de Gay-Lussac, e o êmbolo será deslocado. Um fato importante de falarmos nesse tema, é que está intimamente ligado ao trabalho de uma força, bem como a temperatura, volume e energia interna de um gás perfeito. No estudo da termodinâmica temos que, para um determinado gás, podemos calcular o trabalho da força exercida por ele. Para isso, vamos imaginar um vaso com um êmbolo.
Fórmula do trabalho em um gás ideal : cuidado com o sinal da variação de volume! Sabendo-se que um gás ideal contido em um sistema de cilindro e êmbolo recebe uma quantidade de calor igual a 6. Este ciclo, com a realização de trabalho de 7J, ocorre em três processos sucessivos. Calcule o trabalho associado à expansão isotérmica e reversível de mol de gás ideal de 7L até 150L, em o C. Geralmente, desvios de um gás ideal tendem a diminuir com mais alta temperatura e menor densidade, como o trabalho realizado por forças intermoleculares tornando-se menos significativas comparadas com a. Gás ideal Física O gás ideal é um modelo idealizado no qual o gás se move ao acaso, sendo que suas moléculas se chocam elasticamente, apresentam volume próprio e não exercem ações mútuas. Um gás ideal é um modelo idealizado para o comportamento de um gás.
Para iniciar os estudos sobre os gases, cabe lembrar que eles não possuem o mesmo comportamento dos sólidos e dos líquidos, uma vez que ocupam todo o espaço de um recipiente em que estão contidos, e também porque podem ser submetidos a diferentes pressões. Trabalho em Transformação Isobárica. Qual o trabalho realizado nessa transformação, em joules? Use: cal = J Cv = calor específico em volume constante = 6. ENEM) – Um motor só poderá realizar trabalho se receber uma quantidade de energia de outro sistema. No caso, a energia armazenada no combustível é, em parte, liberada durante a combustão para que o aparelho possa funcionar.
OBS: – O aluno só pode usar essa equação de resolução por ser uma transformação reversível e isotérmica de um gás ideal. O aluno deve entender que precisa usar um ponto qualquer do grafico da questão para estimar o valor do produto n. A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão. A soma dos itens corretos equivale a _____ 03.

Qual a energia interna de 3m³ de gás ideal sob pressão de 5atm? Quando são colocados moles de um gás em um recipiente com êmbolo que mantém a pressão igual a da atmosfera, inicialmente ocupando 2m³. A variação de energia interna do. A força de interação elétrica entre as partículas devem ser nulas, ou seja, elas devem estar bem afastadas para que não haja força elétrica. Em um processo a pressão constante de 0. Por exemplo, dwextra pode ser o trabalho elétrico de um acorrente através de uma resistência.
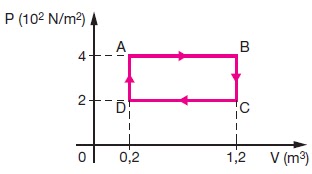
Se você continua tendo problemas, verifique o relógio de seu computador e certifique-se de que a data de hoje esteja definida corretamente. Uma máquina térmica industrial utiliza um gás ideal , cujo ciclo de trabalho é mostrado na figura abaixo. Calcule a quantidade de calor trocada pelo gás com o ambiente ao longo de um ciclo.
Se o gás mantiver a mesma temperatura e as massas moleculares forem duplicadas, qual será a nova velocidade média? Na mesma transformação, o gás realiza 2J de trabalho. Questões resolvidas de vestibulares sobre 1ª e 2ª Lei da Termodinâmica, Energia Interna, Ciclo de Cannot e trabalho de um gás 1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor era U=100J, qual será esta energia após o recebimento? Pense, por exemplo, na tarefa de aquecer um gás.
Se ele aquece, sua energia interna aumenta. Logo, essa energia deve ser oriunda de alguma fonte. Vimos que trabalho e calor são duas formas de mudarmos a energia de um sistema.

Se um sistema recebe calor, sua energia tende a aumentar. Mas pense agora no papel do trabalho. Para um gás ideal , essa energia pode ser determinada pela energia cinética das moléculas (vibração e rotação) e da energia potencial, devido a forças intermoleculares. O ciclo da figura abaixo representa a operaçãoo de um motor de combustão interna de gasolina (ciclo de Otto).
Determine as razões entre as pressões p 3. Um gás monoatômico e ideal sofre uma expansão adiabática, realizando sobre um pistão um trabalho termodinâmico igual a 4J.