Quando houver diminuição da temperatura absoluta, há uma variação negativa de energia interna. E quando não houver variação na temperatura do gás, a variação da energia interna será igual a zero. Com esses dados podemos determinar a variação da energia interna , que será: ΔU = 4. U = 37J Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás. A energia interna é uma função de estado de forma que sua variação depende apenas dos estados inicial e final. Há duas formas de se fazer a energia interna de um sistema fechado variar: via calor, e via trabalho.

Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre. Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Assim, podemos dizer que a energia interna de um sistema varia diretamente com a temperatura.
Exceto nas mudanças de estado. A variação de energia interna é independente dos estados intermediários. Importante: Em um ciclo, a variação de energia interna sempre será nula, ou seja, delta U = 0. Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W. Não se pode medir a quantidade de energia interna de um sistema, pois nunca se sabe quando acabou a capacidade de um sistema realizar trabalho. Assim o que se faz é medir a variação de sua energia interna , ou seja, sabendo-se quanto um sistema cedeu de energia , seja na forma de calor ou de trabalho, e invocando a Lei da Conservação de.
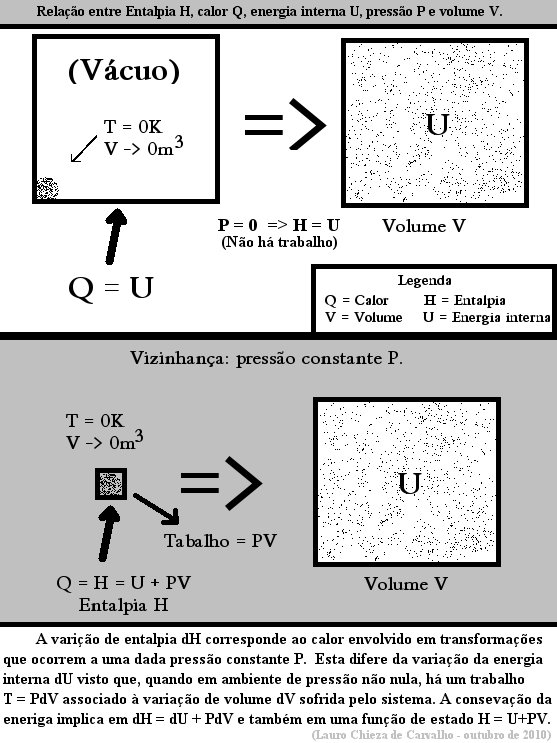
A termodinâmica é uma área da Física que estuda as transferências de energia. Variação da energia interna. U representa a energia interna do sistema e PV mensura a quantidade de energia associada ao conjunto sistema-vizinhança devido ao fato do sistema ocupar um volume V quando submetido à pressão constante P, ou seja, o máximo trabalho executável pela vizinhança sobre o sistema.
E continua a ocorrer enquanto houver diferença entre as temperaturas, isto é, até se alcançar o equilíbrio térmico. Através de toda essa variação de temperatura, pressão e volume, a primeira lei da termodinâmica relata essa variação entre a energia interna de um sistema que pode ser expresso através de diferenças no calor trocado com um meio externo todo ele realizado, tornando essa transformação única. Energia interna para gases diatômicos.
Para os gases diatômicos ideais, a energia interna é dada por uma equação um. As energias de campos radiantes confinados pelas fronteiras do sistema, tipicamente as energias de fótons térmicos confinados. Ou seja, todo o trabalho associado ao gás é transformado em energia interna.
Mas note que o sinal de menos nos leva a uma conclusão: – Se o gás é comprimido, o trabalho é negativo. Não podemos nos esquecer de que a energia interna de um gás é uma grandeza positiva pelo fato de ser diretamente proporcional à temperatura do gás. No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero.
Para um gás com n mols, a variação da energia interna total pode ser. Agora considere o fornecimento de uma determinada quantidade de calor q ao sistema, que realizará um trabalho τ sobre o meio ambiente. Assim H será também uma função de estado. Uma garrafa hermeticamente fechada contém litro de ar.
Ao ser colocada na geladeira, onde a temperatura é de 3°C, o ar interno cedeu calorias até entrar em equilíbrio com o interior da geladeira. Pessoal, não consegui calcular essa variação de energia interna e de entropia, será que alguém pode me ajudar? Um sistema termodinamico realiza um trabalho de 40kcal quando recebe 30kcal dem calor. Nesse processo, a variação de energia interna desse sistema é: a) zero b) kcal c) kcal d) -10kcal e) kcal Me ajudem, nao sei essa!
A temperatura está diretamente ligada à energia interna. Quanto maior a variação da energia interna , maior a temperatura! No caso como o pistão pode se mover, o gás pode realizar trabalho! Quando o gás realiza trabalho, ele diminui a variação de energia interna , diminuindo assim o aumento de temperatura! Agora, caso o gás mantenha o mesmo volume mesmo ao ser resfriado, dizemos que o calor que ele perdeu foi igual à perda de energia interna.
Precisamos definir uma outra grandeza: a entalpia. Sim, essas fórmulas existem. Mas ainda existe um problema nelas. Boltmann criou um método de cálculo (teorema da equiparação) que permitia estimar a energia interna de uma molécula através da equação R = K. Perceba que R, P, e T são valores positivos.
Em uma transformação adiabática, o trabalho será realizado sobre gás quando a variação da energia interna é positiva. Numa transformação isocórica, a variação de energia interna do gás é igual à quantidade de calor trocada com o meio exterior. Qual a variação na energia interna do gás? Calcule o calor específico molar a volume constante. Dessa maneira, em uma transformação, a variação da energia interna ΔU do sistema depende do calor Q trocado e do trabalho τ na transformação.
A 1º Lei da termodinâmica estabelece que a variação da energia interna de um sistema corresponde à energia térmica (Q) recebida pelo sistema na forma de calor menos a energia cedida pelo sistema à sua vizinhança na forma de trabalho (W). O sistema trocou calor com o meio ambiente. Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente.
A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão. No entanto, até o momento, não se sabe uma forma de determinar experimentalmente o valor exato da entalpia de cada um dos reagentes ou de cada um dos produtos.