Quando houver diminuição da temperatura absoluta, há uma variação negativa de energia interna. E quando não houver variação na temperatura do gás, a variação da energia interna será igual a zero. Este vídeo ensina: Trabalhou exemplo calcular a variação da energia interna de um gás usando a primeira lei da termodinâmica.
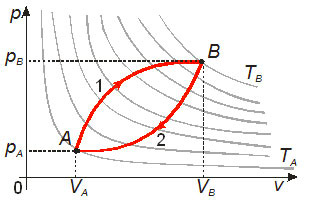
Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Vamos calcular a variação de energia interna de um corpo entre duas adiabáticas. Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás.
Já a variação da energia interna pode assumir valores diferentes, como sendo positiva, negativa ou zero, dependendo da variação da temperatura absoluta do gás. Em diversas situações, é interessante saber calcular a variação da energia interna (ΔU) de um gás, pois essa grandeza indica se o gás recebeu ou cedeu energia. Caso a variação da energia. Assim, podemos dizer que a energia interna de um sistema varia diretamente com a temperatura. Exceto nas mudanças de estado.

A variação de energia interna é independente dos estados intermediários. Importante: Em um ciclo, a variação de energia interna sempre será nula, ou seja, delta U = 0. Há duas formas de se fazer a energia interna de um sistema fechado variar: via calor, e via trabalho. A 1ª Lei da termodinâmica estabelece que a variação da energia interna ( ) de um sistema corresponde à energia térmica (Q) recebida pelo sistema na forma de calor menos a energia cedida pelo sistema à sua vizinhança na forma de trabalho (W). Ela corresponde a soma da energia cinética (Ec), produzida pelo movimento dos corpos, com a energia potencial elástica (Epe) ou gravitacional (Epg), produzida por meio da interação dos corpos relacionada com a posição dos mesmos.
A unidade de energia no Sistema Internacional de Unidades (SI) é o Joule (J). Em uma reação química, tanto os reagentes quanto os produtos apresentam uma quantidade de energia interna : a entalpia. Como a medida da entalpia específica de cada substância em uma reação é muito complexa, é realizado o cálculo da variação da entalpia da reação (ΔH).
Como calcular a variação de energia interna em joules? Precisa de esclarecimento? Determinea) o instante em que os móveis estarão lado a lado. O texto a seguir é referente às questões 1 e 12.
O gráfico a seguir representa a velocidade em função dotempo para um móvel que realiza movimento uniforme-mente variado, sobre uma dada. O significado de trabalho na termodinâmica e como calcular o trabalho realizado pela compressão ou expansão de um gás. Exemplo do cálculo da energia interna e. Veremos, no entanto, que a energia interna dos gases reais e da matéria nos demais estados físicos, sólido ou líquido, que ela pode apresentar varia mesmo em mudanças de estado isotérmicas. Como a energia interna é uma propriedade de estado extensiva, se variamos a quantidade de matéria do sistema sua energia interna também muda. Bem, como a entropia é uma função de estado, podemos calcular a variação de entropia por qualquer “caminho”, como costumamos fazer com a energia interna.

Bom, como a variação de energia interna é nula, qual processo você usaria? Outro ponto importante é que visto que o ΔH depende de uma série de fatores, tais como temperatura, pressão, estado físico e número de mol, criou-se um referencial para que se compare a entalpia da substância, que foi. Agora considere o fornecimento de uma determinada quantidade de calor q ao sistema, que realizará um trabalho τ sobre o meio ambiente.
Este hecho se conoce como la ley de Joule. Las temperaturas deben ir expresadas en Kelvin. Não podemos nos esquecer de que a energia interna de um gás é uma grandeza positiva pelo fato de ser diretamente proporcional à temperatura do gás. No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero. Para um gás com n mols, a variação da energia interna total pode ser.
Essa definição pode envolver também a energia presente na formação da mesma ligação entre os mesmos átomos (separados), mas ela apresentará sinal diferente. Observe a figura a seguir: A figura mostra um cilindro com gás em seu interior que está sendo submetido a uma variação de temperatura. O cilindro da figura contém uma massa de gás ideal. A energia livre de Gibbs (∆Gº), é uma grandeza termodinâmica definida como a diferença entre variação de entalpia (∆Hº) e a temperatura (T) vezes a variação de entropia (∆Sº) em uma reação. De acordo com a equação abaixo: ∆Gº=∆Hº – T∆Sº.
A entalpia, sendo a soma de uma energia com um produto (PV) que tem dimensões de energia , tem de ser expressa também em unidades de energia (Joule (J), caloria (cal), etc). A entalpia H pode ser deduzida da aplicação da primeira lei, num processo a pressão constante.