
Esta energia é uma característica do estado termodinâmico e deve ser considerada como mais uma variável que pode ser expressa em termos de pressão, volume, temperatura e número de mols. Para que este somatório seja calculado, são consideradas as energias cinéticas de agitação , potencial de agregação, de ligação e nuclear entre as partículas. A energia cinética é simplesmente a energia interna do gás perfeito e depende completamente de sua pressão, volume e temperatura termodinâmica.
A energia interna de um gás ideal é proporcional à sua massa (número de moles) n e sua temperatura T. Quando a temperatura de um gás aumenta ou diminui, significa que este gás ganhou ou perdeu energia. Experimentos de Joule para a energia interna. Conforme Joule estudava a energia interna de um gás ideal , promoveu alguns outros experimentos, como os da expansão livre, e o de trabalho necessário para alterar a temperatura de um sistema. Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre.
Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Qual a energia interna de 3m³ de gás ideal sob pressão de 5atm? Neste caso devemos usar a equação da energia interna juntamente com a equação de Clapeyron, assiTrabalho de um gás.
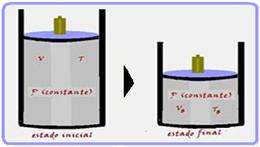
Quando são colocados moles de um gás em um recipiente com êmbolo que mantém a pressão igual a da atmosfera, inicialmente ocupando 2m³. Desse modo, o trabalho realizado sobre o gás poderia ser determinado facilmente resultando no calor fornecido ao calorímetro, desde que se este trabalho fosse convertido inteiramente em calor, sem gerar alteração da energia interna do gás. A fim de verificar a hipótese, Joule começou a investigar se a energia interna de um gás variava.
O pistão é empurrado lentamente para baixo, de tal maneira que a temperatura do gás permaneça em 20°C. Um gás ideal é confinado num cilindro, por um pistão. Durante a compressão, o trabalho realizado sobre o gás foi de 750J. Portanto gases ideais são os únicos que não diminuem sua temperatura quando se expandem livremente.
Lembre-se em uma expansão livre, o volume do gás. UEL-PR) – Fornecem-se calorias de energia sob forma de calor a um sistema termodinâmico, enquanto se realiza sobre ele trabalho de joules. Com a ajuda de William Thomson, o Lorde Kelvin, aprimorou a experiência inicial da expansão livre, com o objetivo de se detectar pequenas variações.
Então, acabamos de ver que existe uma energia interna do gás devido à energia cinética de suas moléculas. Essa energia interna , como vimos, é a energia cinética média de todas as moléculas do gás. Pode-se demonstrar, utilizando métodos estatísticos (que não serão demonstrados aqui pois são mais longos e complexos do que esse texto se propõe), que a energia interna de um gás ideal só DEPENDE DE SUA TEMPERATURA, ou seja, só depende do estado do gás. Em uma transformação isobárica, o volume de um gás ideal aumenta de 10-mpara 2. Qual é, em Joules, a variação da energia interna do gás ? A eficiência de uma máquina térmica que trabalha segundo o ciclo de Carnot independe da energia interna da substância de operação. O aumento da temperatura de um gás ideal só é possível se houver um fluxo de calor para o seu interior.
Este ciclo, com a realização de trabalho de 7J, ocorre em três processos sucessivos. Uma massa de mols de certo gás perfeito tem volume de 1litros a temperatura de 27º C. A partir desse estado, varia-se a temperatura do gás , mantendo-se constante sua pressão e as caracteristicas de gás ideal. Energia interna (U) de um gás ideal ? Portanto, em um processo isotérmico, a energia interna de um gás ideal é constante.
Ao empurrar-se o êmbolo, o volume ocupado passa a ser 1m³. Observe a figura a seguir: A figura mostra um cilindro com gás em seu interior que está sendo submetido a uma variação de temperatura. O cilindro da figura contém uma massa de gás ideal.
Simulado matérias específicas de Química com gabarito. Considere o ar como um gás ideal. Sabe-se que, para um gás ideal , a energia interna é proporcional à sua temperatura. Com base nessas informações, é CORRETO afirmar que, no interior da seringa: A) a pressão do ar aumenta, e sua temperatura diminui. B) a pressão do ar diminui, e sua temperatura aumenta.
Uma determinada massa de gás ideal , inicialmente a uma pressão e temperatura Pe T é submetida a um processo de alteração de suas variáveis de estado até que estas atinjam novos valores Pe T2. Durante o ciclo completo, a variação total da energia interna é nula e portanto W = Q de modo que todo o calor absorvido pelo gás foi usado na realização de trabalho, não contribuindo em nada para a alteração da energia interna do sistema. Por exemplo, dwextra pode ser o trabalho elétrico de um acorrente através de uma resistência. EE E int int, transl int, rot. UFRGS) O desenho mostra um cilindro de metal dotado de um êmbolo móvel em cujo interior encontra um gás ideal em equilíbrio termodinâmico.
Em dado instante uma força de módulo F age sobre o êmbolo que comprime o gás rapidamente.