Esta equação de estado possibilita descrever o comportamento de um gás ideal , com base no conhecimento da sua pressão, volume ou temperatura. Um gás ideal é constituído por partículas sem volume e onde não existem forças de interacção entre elas, e por isso, o conceito de gás ideal é uma aproximação de um gás real. Série: Estudo dos gases (EG) Hoje mostramos nesta aula como a equação do gás ideal foi desenvolvida a partir da equação geral dos gases. Observe que essa equação relaciona as três variáveis de estado dos gases (pressão (P), volume (V) e temperatura (T)) para uma quantidade “n” de mols de partículas de um gás , descrevendo, desse modo, o comportamento de um gás ideal. Mas como se chegou a essa equação ? Qualquer equação que apresente uma relação entre as variáveis de estado de um gás é denominada equação de estado do gás.

A equação de estado do gás perfeito ou ideal é conhecida como equação de Clapeyron, em homenagem a Benoit Paul Émile Clapeyron que, em meio a muitos outros resultados importantes, escreveu tal equação como. Essa é conhecida como a equação geral dos gases, que aborda as três variáveis de estado (P, V e T). A equação geral nos permite calcular, por exemplo, o volume de um gás que passou por alterações de temperatura e pressão.
Um objeto prático que nos ajuda a entender a aplicação deste princípio: as latas de aerossóis. A distinção entre uma equação fundamental e uma equação de estado é feita em função das grandezas relacionadas, e exige alguma compreensão sobre termodinâmica. A exemplo, a energia interna de um gás ideal , quando expressa em função do número de partículas do sistema, de seu volume e de sua entropia, constitui uma equação. Quanto aos gases, é CORRETO afirmar que: a) sob pressão de uma atmosfera e temperatura ambiente, um mol de qualquer gás ocupa o volume de 2litros.

A equação des envolvida por Émile Clapeyron relaciona as três variáveis de estado (pressão, volume e temperatura) com a quantidade de partículas (número de mols) que compõe um gás. O gás ideal , a equação de estado de um gás ideal , sua temperatura e pressão, volume … uma lista de parâmetros e definições que operam na seção correspondente da física pode ser continuada por um longo período de tempo. Exercícios sobre equaÇão de estado de um gás ideal (clapeyron) e densidade gasosa 01. UFF) O hélio, depois do hidrogênio, é o gás mais leve que existe. Dentre suas diversas aplicações, é utilizado para encher balões que transportam à atmosfera instrumentos de pesquisa.
A equação de estado de um gás ideal é escrita da seguinte forma: P = pressão, V = volume, n = quantidade de gás , R = constante dos gases perfeitos, T = temperatura É possível notar que não há nessa equação quaisquer considerações sobre a natureza química do gás. Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e. Algumas são de natureza semiempírica e outras se baseiam na teoria da conduta molecular. As principais equações de estado são: 2. Gás é um fluido que apresenta somente a propriedade de expansibilidade. Gás Ideal (1) Para um gás , uma equação de estado é uma relação entre pressão (P), volume (V), temperatura (T) e composição ou número de mols (n).
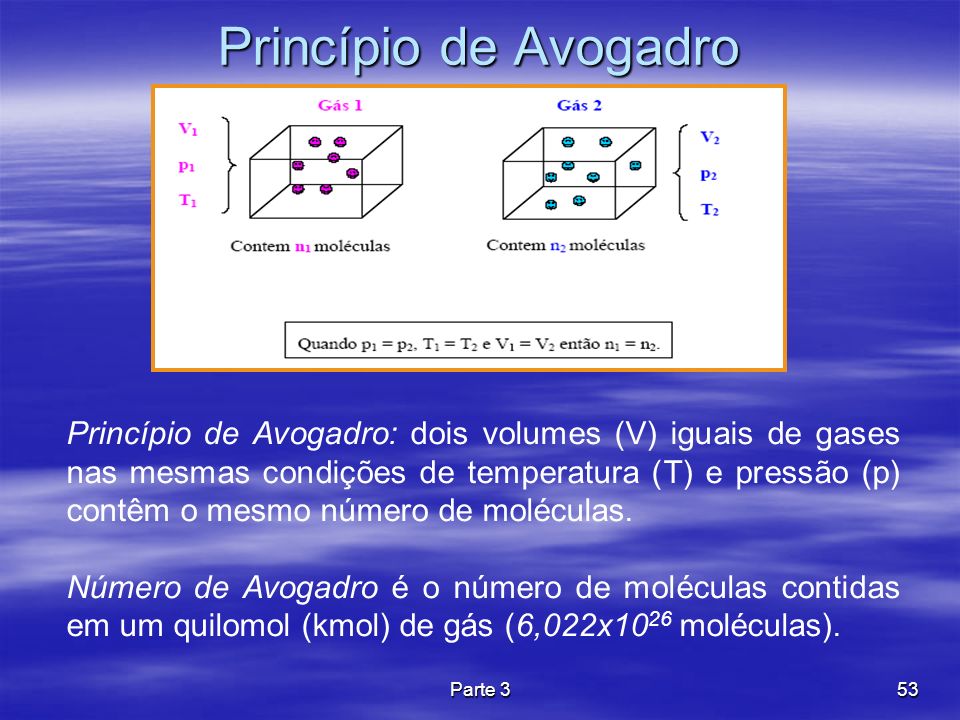
De seguida, apresenta-se a dedução da equação de estado de um gás ideal. Transformações de um gás : com temperatura constante e com pressão constante. Dentro de um contentor cilíndrico, que possui um êmbolo móvel, aprisiona-se uma certa quantidade de gás.
A equação de estado de van der Waals para um gás corrige as hipóteses básicas para a validade da equação de estado de um gás ideal , considerando que as partículas (átomos ou moléculas) ocupam um certo volume e que interatuam entre si de forma atrativa ou repulsiva. Relacionando as Leis de Boyle, Charles Gay-Lussac e de Charles é possível estabelecer uma equação que relacione as variáveis de estado : pressão (p), volume (V) e temperatura absoluta (T) de um gás. Cuidado: gás ideal é uma substância idealizada! Os gases reais se comportam como gás ideal a baixas pressões e altas temperaturas.
A partir da equação de estado do gás ideal , é possível a determinação das coordenadas termodinâmicas de um sistema. A temperatura absoluta (T), a pressão (P) e o volume (V) são as denominadas variáveis de estado de um gás ideal. A Lei dos Gases Ideais é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, diversos processos industriais empregam determinadas condições de pressão e temperatura, as quais a lei dos gases ideais não são exatamente obedecidas. Um gás real aproxima-se do comportamento de um gás ideal à medida que diminui a pressão e aumenta a temperatura.
A baixas pressoes e altas temperaturas todos os gases reais tendem para um mesmo comportamento, o qual, para o seu estudo, é aproximado por um modelo, o chamado de “ Gas Ideal ”. O estado do gas é descrito por varios parámetros, que são: o volume, v, a pressão, p, a temperatura, T, e a quantidade de substância (número de moles), n. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. Defina a pressão parcial de um gás. O comportamento físico de um gás não depende de sua composição química, mas de três variáveis: o volume (V), a pressão (P) e a temperatura (T). Change Language Mudar idioma. Constante universal dos gases perfeitos. Um guia para a realização profissional e financeira.
O físico parisiense, Benoit Pierre Emile Clapeyron, estabeleceu uma equação que relaciona as três variáveis de estado de um gás , ou seja, pressão (p), temperatura (T) e volume (V) para uma quantidade de matéria igual a n, descrevendo totalmente o comportamento de um gás ideal. Equação de Clapeyron – Equação geral de estado.