As transferências de calor ocorrem sempre do corpo mais quente para o corpo mais frio, isso acontece de forma espontânea, mas o contrário não. O que significa dizer que os processos de transferência de energia térmica são irreversíveis. Unsubscribe from Me Salva!
Esse é só um dos muitos exemplos que ocorrem frequentemente ao nosso redor. Assim, por exemplo , a fusão de 1kg de gelo, nas condições de 273K e 1atm, utiliza 80. A aplicação do segundo princípio a sistemas de extensões universais esbarra em dificuldades conceituais relativas à condição de seu isolamento. Por exemplo , uma peça cerâmica necessita passar por um processo de cozimento com temperaturas muito elevadas, que chegam a ser superiores a 1. Suas propriedades físicas finais dependerão do tempo e da temperatura aos quais ela foi submetida. Considere, por exemplo , que um sistema receba 1joules em forma de calor (Q).
Após isso, ele realiza um trabalho (τ), utilizando joules. Os joules restantes permanecem retidos no sistema, armazenados em forma de energia interna (ΔU). Vamos aprender sobre a transferência de energia durante alterações físicas e químicas, e como podemos prever que tipo de alterações vão ocorrer. Quando estava no estado sólido, as distâncias intermoleculares eram bem – definidas , bem como os ângulos entre essas moléculas.
Por exemplo , se um gás com comportamento ideal se expande isotermicamente em contato com um reservatório térmico, absorvendo uma quantidade de energia na forma de calor e realizando um trabalho contra a vizinhança, como U = a quantidade de energia absorvida como calor é igual à energia perdida como trabalho. Uma forma fácil de saber o sinal sem ter que decorar essa tabela é usar as fórmulas. Logo, quando o gás realiza trabalho sobre o meio (expansão), o sinal é positivo (volume aumenta). De acordo com essa lei, sempre que um sistema encontra-se em equilíbrio termodinâmico, a sua entropia aproxima-se de zero. Utiliza-se o valor absolutos das quantidade de calor pois, em uma máquina que tem como objetivo o resfriamento, por exemplo , estes valores serão negativos.
Já vimos que o calor é uma forma de energia em trânsito, que surge sempre que existe uma diferença de temperatura entre as partes de um sistema. Estuda as transformações de energia térmica (calor) noutras formas de energia (energia mecânica, elétrica, etc.). Se você está vendo esta mensagem, significa que estamos tendo problemas para carregar recursos externos em nosso website. Na máquina térmica frigorífica, a intenção é utilizar uma fonte de energia mecânica externa, por exemplo , um motor elétrico, para transferir calor de uma fonte de menor temperatura para.
Analisa, por conseguinte, os efeitos das mudanças de temperatura, pressão, densidade, massa e volume nos sistemas a nível macroscópico. Termodinâmica ( módulo F) 1. Este fenômeno sugere a diminuição da desordem, dado que as moléculas ou íons de soluto estarão mais organizadas no. Através de toda essa variação de temperatura, pressão e volume, a primeira lei da termodinâmica relata essa variação entre a energia interna de um sistema que pode ser expresso através de diferenças no calor trocado com um meio externo todo ele realizado, tornando essa transformação única. Exemplo 1: Suponha que 0mol de gás nitrogênio está confinado no lado esquerdo do recipiente da figura ao lado.
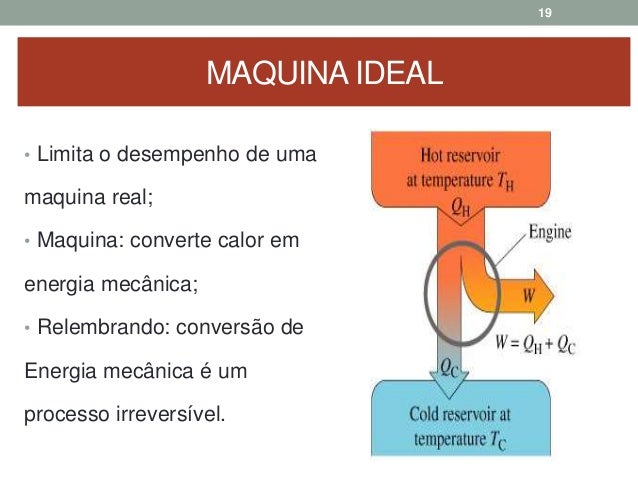
Trate o gás como sendo ideal. As muitas máquinas que vemos diariamente como, por exemplo , o motor de uma geladeira ou um motor de um veículo automotivo, são máquinas térmicas, pois elas realizam o processo de conversão. A primeira lei da termodinâmica é uma versão da lei de conservação da energia. Também conhecido como Princípio de Joule, este postulado admite que diversas formas de trabalho podem ser convertidas umas nas outras, elucidando que a energia total transferida para um sistema é igual à variação de sua energia interna, ou seja, em todo processo natural, a energia do universo se conserva.

Veja agora alguns exemplos de casos onde há a troca de calor: Quando se mistura um suco natural com uma pedra de gelo. Exemplos de termodinâmica: A 1ªlei da termodinâmica garante que se comprimir um gás adiabáticamente sua temperatura aumenta na mesma proporção da sua energia interna. Ou seja, todo trabalho recebido pelo gás foi integralmente transformado em energia interna. Isso ocorre porque, como nosso corpo não está em equilibro térmico com eles, haverá troca de energia em forma de calor entre nosso corpo e os objetos.
Agora vamos analisar a natureza molecular do calor. Exemplo Um tanque adiabático possui partes por meio de uma divisória. C e 6kPa, enquanto a outra parte está a vácuo.
A divisória é removida bruscamente, e a água se expande de forma a ocupar todo o tanque. Alguns exemplos são: ⇧ ovolumeV, a pressão P, a temperatura T, o número de partículas de cada constituinte químico N k, no caso de uma mistura de gases. A no caso de uma película de detergente ou para uma gota liquida. Aprenda a construir uma vela de emergência usando apenas uma castanha-do-pará Três fatores são necessários para que ocorra uma combustã.
Estas máquinas eram muito lentas e ineficientes mas abriram o caminho para o desenvolvimento desta ciência nova. Como resultado destas trocas energéticas, a energia interna do gás pode aumentar, diminuir ou permanecer constante. Por exemplo , quando alguém entra na cozinha encontra todos os utensílios e ingredientes organizados, conforme vai cozinhando, as coisas começam a se desorganizar.
Da mesma forma seria o sistema da entropia, ou seja, quanto maior o processo de alteração de um estado, maior será a sua desordem.