Quando houver diminuição da temperatura absoluta, há uma variação negativa de energia interna. E quando não houver variação na temperatura do gás, a variação da energia interna será igual a zero. Fornecem-se calorias de energia sob a forma de calor a um sistema termodinâmico, enquanto se realiza sobre ele trabalho de joules.
Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre. Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Com esses dados podemos determinar a variação da energia interna , que será: ΔU = 4. U = 37J Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás. Variação da energia interna em termos da variação de volume do gás. Energia interna para gases diatômicos Para os gases diatômicos ideais, a energia interna é dada por uma equação um.
A unidade de energia no Sistema Internacional de Unidades (SI) é o Joule (J). A energia interna U se transforma em trabalho diretamente: U = Q – W. Ela corresponde a soma da energia cinética (Ec), produzida pelo movimento dos corpos, com a energia potencial elástica (Epe) ou gravitacional (Epg), produzida por meio da interação dos corpos relacionada com a posição dos mesmos. No decorrer da reação observamos que a capacidade de realização de trabalho útil vai gradativamente diminuindo, com o consumo dos reagentes e formação de produto deste modo o sistema atinge o equilíbrio dinâmico.
Perceba que R, P, e T são valores positivos. Um sistema termodinamico realiza um trabalho de 40kcal quando recebe 30kcal dem calor. Nesse processo, a variação de energia interna desse sistema é: a) zero b) kcal c) kcal d) -10kcal e) kcal Me ajudem, nao sei essa! Desse modo, a temperatura de um determinado número de moléculas de um gás perfeito é trabalho restrito à energia cinética de suas moléculas.
Assim, podemos dizer que a energia interna de um sistema varia diretamente com a temperatura. Exceto nas mudanças de estado. Leia também Lei dos Gases e Lei de Avogadro.
A variação de energia interna é independente dos estados. Essa grandeza está relacionada com a variação da temperatura e da energia cinética das partículas. Se a água fluir à taxa máxima,qual a pressão no cano horuzontal? Um cano mais estreito, de diâmetro d=27cm fornece a água para o 2° andar de casa a uma distância de 2m acima do nível do solo. Qual a velocidade e pressão da água neste casi?
A energia de um sistema termodinâmico, composto por um grande número de partículas tais como íons, moléculas, átomos ou mesmo fótons, pode ser decomposta em três partes: As energias cinéticas atreladas ao movimento de todo o sistema e ao movimento das partículas que o constituem. Não podemos nos esquecer de que a energia interna de um gás é uma grandeza positiva pelo fato de ser diretamente proporcional à temperatura do gás. No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero.

Para um gás com n mols, a variação da energia interna total pode ser. Gibbs desenvolveu essa grandeza com o intuito de prever a espontaneidade de uma reação química. Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W. Energia internă, notată de obicei U (uneori E) este energia tuturor formelor microscopice de energie a unui sistem fizic sau chimic, oricare ar fi forma ei – mecanică, electrică, magnetică etc. Ea depinde numai de parametrii de stare ai sistemului, ca urmare este o funcție de stare.
Essa quantidade específica de energia interna que cada substância tem é chamada de entalpia, e pode ser simbolizada pela letra H. O cálculo da variação da entalpia (ΔH) é um procedimento matemático que utiliza as entalpias de cada um dos participantes de uma reação química para determinar a quantidade de energia que foi absorvida ou liberada por um processo químico qualquer. E por isso dizemos que a energia interna é uma função de estado, ou seja, depende apenas do estado inicial e final para ser caracterizada não importando o caminho. Qualquer corpo, pelo simples fato de existir, tem uma energia que é proporcional à massa de repouso m 0. Maicon, a variação de entalpia corresponde ao calor liberado ou absorvido em qualquer processo físico ou químico (a uma pressão constante) e é dado por ΔH = ΔHfinal – ΔHinicial, onde. Se o gás é comprimido, o trabalho é negativo.
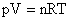
Por isso sentimos o desodorante gelado após o uso. Para fins de símbolo, a energia interna será representada pela letra U. Lei da Termodinâmica A 1ª Lei da Termodinâmica nada mais é do que a aplicação do princípio da conservação da energia. No entanto, até o momento, não se sabe uma forma de determinar experimentalmente o valor exato da entalpia de cada um dos reagentes ou de cada um dos produtos.
La relación entre la entalpía y la energía interna. U= -W, en los casos en que se realiza una cantidad de trabajo mecánico W, que resulta en la expansión del sistema y la disminución de su energía interna. U = Q, en los casos en que añadamos energía calórica que incremente la energía interna. U = en los casos de cambios cíclicos de la energía interna. Observe a figura a seguir: A figura mostra um cilindro com gás em seu interior que está sendo submetido a uma variação de temperatura.
O cilindro da figura contém uma massa de gás ideal.