
Gay-Lussac determinaron de modo experimental que a bajas presiones el volumen de un gas es proporcional a su temperatura. El gas ideal es un gas de partículas consideradas como objetos puntuales que interactúan solo por colisiones elásticas y llenan un volumen de tal manera que su recorrido libre promedio entre colisiones es mucho más grande que su diámetro. Tales sistemas son aproximados por los gases monoatómicos, el helio y los otros gases nobles.

Recuerda que un gas ideal no es más que un gas teórico en el que sus partículas, con desplazamiento aleatorio, no interactúan entre sí. La mayoría de los gases reales, a temperaturas relativamente altas y presiones pequeñas pueden considerarse gases ideales y por tanto podemos aplicar esta expresión como su ecuación de estado en los. Um dos tópicos mais importantes de Física Térmica. Sempre presente em vestibulares tradicionais e muito frequente na prova do ENEM. No existe algo que sea en verdad un gas ideal, pero sigue siendo concepto muy útil y sencillo, relacionado realmente, con el hecho que todos los gases reales se aproximan a la abstracción de los gases ideales en su comportamiento, siempre que la densidad sea suficientemente pequeña.
Comportamento dos gases segundo as leis dos gases. A pressão (p) é produzida pelo movimento das partículas do gás dentro do recipiente. E a temperatura (t) está relacionada com a energia cinética média das partículas do gás em movimento.
Mas em um sistema em especial, a dilatação não costuma ser tão desprezível: os gases. Pensemos então neste caso. Suponha um gás encerrado em um recipiente fechado por um êmbolo móvel, que pode deslizar sem resistência com as paredes do recipiente. Un gas ideal es un conjunto de átomos o moléculas que se mueven libremente sin interacciones. La presión ejercida por el gas se debe a los choques de las moléculas con las paredes del recipiente.
El comportamiento de gas ideal se tiene a bajas presiones es decir en el límite de densidad cero. La ecuación de estado de un gas ideal está basada en la hipótesis de que las interacciones entre las moléculas de un gas a densidad muy baja son despreciables. Además, en estas condiciones, las moléculas que constituyen el gas se consideran partículas puntuales. No existe algo que seaen verdad un gas ideal, pero sigue siendo concepto muy util y sencillo, relacionado realmente, con el hecho que todos los gases reales se aproximan a la abtracción de los gases ideales en su comportamiento, siempre que la densidad sea suficientemente pequeña. V=nRT se llama ecuación de estado de un gas ideal.
Al aplicar una presión externa menor P el gas se expandirá hasta V 2. Thermodynamics is the branch of physics that deals with heat and temperature, and their relation to energy, work, radiation, and properties of matter. The behavior of these quantities is governed by the four laws of thermodynamics which convey a quantitative description using measurable macroscopic physical quantities, but may be explained in terms of microscopic constituents by statistical. Energia Interna dos Gases. Um gás que possua uma temperatura diferente do zero absoluto (K) possui uma energia cinética interna representada pela energia cinética de suas partículas em. Los gases reales que más se aproximan al comportamiento del gas ideal son los gases monoatómicos en condiciones de baja presión y alta temperatura.
Gases compostos de átomos monoatômicos não interagentes (tais como He, Ar, Ne) satisfazem essas equações em temperaturas tais que seja pequeno quando comparado com as energias de excitação eletrônica e em pressões baixas ou moderadas. Para tais gases ideais monoatômicos =. El gas contenido en un recipiente, está formado por un número muy grande de moléculas, 6. Cuando se intenta describir un sistema con un número tan grande de partículas resulta inútil (e imposible) describir el movimiento individual de cada componente. En los gases ideales, la energía interna se puede aproximar a la energía cinética media de las partículas que lo componen. La expresión que se recoge más abajo permite determinar su variación en un proceso cuyo volumen permanece constante (proceso isocórico). Dalton describió la mezcla de gases perfectos en función de la presión y su composición.
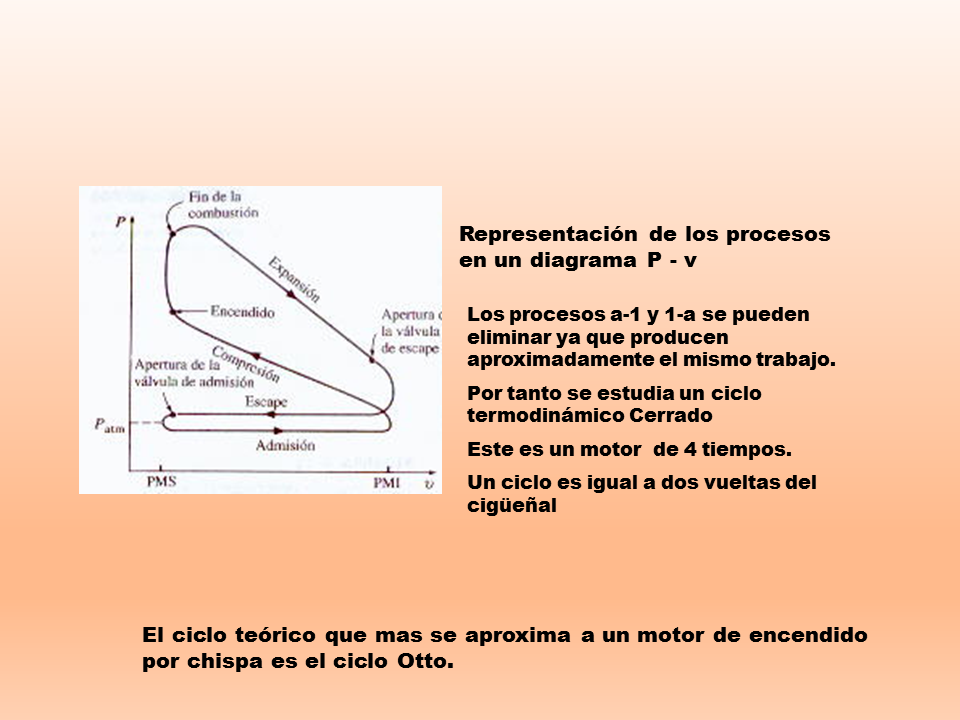
Termodinámica del gas ideal 1. Definición de un gas ideal Podemos definir el gas ideal como el gas hipotético formado por partículas con masa, puntuales (por tanto, sin volumen) y que no interaccionan. Para gases diatômicos, além da translação, haverá vibrações e rotações, num total de seis graus de liberdade. A falha na previsão do valor correto para o calor específico a volume constante de gases diatômicos (e também de sólidos cristalinos monoatômicos) foi o primeiro exemplo histórico da inadequação dos conceitos e. Ejemplo: Cuando un gas se encuentra contenido en un cilindro con émbolo, y éste es calentado por una llama, el gas absorbe un cierto calor Q ya que la temperatura de la llama es mayor que la del gas. A termodinâmica é uma área da Física que estuda as transferências de energia. Confira a seguir uma lista de fórmulas sobre este conteúdo.
ErModinÂMiCa material didático. LA TERMODINAMICA Comprendimos que la termodinámica se utiliza día a día en nuestras vidas por eso es muy importante, la importancia de estos procesos termodinámicos en nuestro entorno y como estos afectan el medio en que vivimos y de allí presentar alternativas de mejoramiento en la conservación del ambiente. Leyes de la termodinamica. La termodinámica es la rama de la física que estudia los efectos de los cambios de temperatura, presión y volumen de un sistema físico (un material, un líquido, un conjunto de cuerpos, etc.), a un nivel macroscópico. O calor pode ser útil, mas também pode ser irritante.
Para obtener una estandarización en la medición de gas , se utilizan presión y temperatura a condiciones estándar. La forma como un gas es medido se llama condición ACTUAL ó real utilizando unidades como ACFM ( pies cúbicos por minuto a condiciones de operación), sin embargo como vimos el volumen cambia cuando la temperatura y presión cambian, aunque la masa permanece constante. El cambio en la energía interna del gas estará dado por la diferencia entre el calor agregado y el trabajo que el gas hace al levantar el émbolo contra la presión atmosférica.
La primera ley nos dice que la energía se conserva.