La característica principal del modelo de Bohr , era la absorción o emisión de energía cada vez que los electrones cambiaban de orbitas permitidas. Estos, coexisten con los niveles de energía mientras rodean el núcleo. Hay que destacar, que los electrones son descritos a través de números cuánticos.
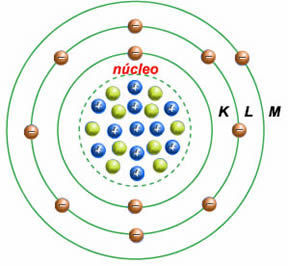
Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos. Diagrama de niveles de energía para los átomos de hidrógeno.
El modelo de Bohr fue capaz de explicar de modo satisfactorio el espectro del átomo de. O modelo de Bohr descreve o comportamento dos átomos de hidrogênio e íons com apenas um elétron. Sistemas de vários elétrons não estão incluídos.
A teoria de relatividade não é considerada, embora seja atribuído ao elétron no estado fundamental do átomo hidrogênio, cerca de da velocidade da luz. Bohr conseguiu explicar como se comportava o átomo de hidrogênio, o que não era possível mediante a teoria atômica de Rutherford. Mas, embora tenha aperfeiçoado o modelo atômico de Rutherfor o modelo de Bohr ainda não é perfeito, uma vez que continuam havendo lacunas por explicar. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica. Apesar de conseguir explicar o movimento do elétron no átomo de hidrogênio, o modelo proposto por Bohr não obteve o mesmo resultado quando aplicado a átomos de outros elementos, não sanando o problema da estrutura atômica.
Qué problemas presenta el modelo atómico de Bohr. La teoría del modelo atómico de Bohr tuvo tres problemas principales o limitaciones importantes que fueron las siguientes: La teoría se adapta al espectro del átomo de hidrógeno pero no se adapta a los espectros que tienen otros átomos. En el estudio de la física, el modelo ( o teoría atómica) de Bohr , es el que describe al átomo como un núcleo pequeño y cargado positivamente , el cual se encuentra rodeado por electrones. No modelo de Thomson (pudim de passas) os elétrons teriam configurações estáveis e oscilariam nessas configurações.
Esse modelo não estava de acordo com a teoria eletromagnética clássica, pois não é possível haver configuração estável em nenhum sistema de partículas carregadas que possuam apenas a interação eletromagnética. También llamado el modelo Rutherford- Bohr. Aunque el modelo de Rutherford fue exitoso y revolucionario, tenía algunos conflictos con las leyes de Maxwell y con las leyes de Newton lo que implicaría que todos los átomos fueran inestables. Niels Bohr , físico dinamarquês, foi quem propôs o primeiro modelo quântico do átomo. Em tais órbitas os elétrons não poderiam permanecer e acabariam por emitir a energia excedente no traslado de um nível para o outro.
O modelo do físico dinamarquês Niels Bohr tentava dar continuidade ao trabalho feito por Rutherford. Para explicar os erros do modelo anterior, Bohr sugeriu que o átomo possui energia quantizada. Cada elétron só pode ter determinada quantidade de energia, por isso ele é quantizada.
Não podemos afirmar com certeza de que Bohr conhecia os estudos anteriores, mas durante o estudo da hitória da ciência, percebeu-se que os modelos anteirores de átomo ajudaram a fazer com que se busca-se por características novas, que talvez já tivessem até mesmo sido citadas por outros pesquisadores não tão conhecidos. El modelo del átomo de Bohr , es una desviación radical de las descripciones clásicas anteriores, fue el primero que incorporó la teoría cuántica y fue el predecesor de los modelos puramente cuánticos mecánicos. Erwin Schrödinger perfeccionó el modelo de Bohr , quien introdujo el concepto de orbital, que es algo diferente al de órbita.
La ditancia de la órbita al núcleo se determina según el número. O espectro atômico do átomo de Hidrogênio foi finalmente explicado por Niels Bohr e seu modelo atômico. Para isso, Bohr forçou um pouco a barra, e decidiu dar como verdade algumas suposições que são os Postulados de Bohr.

Influência do Modelo de Bohr. Enquanto o modelo de Bohr se mostrou inovador em alguns aspectos – a fusão Ryberg de constante e constante de Planck (aka teoria quântica.) Com o modelo de Rutherford – ele fez sofrer de algumas falhas que mais tarde experimentos que ilustram. Para começar, supunha-se que os elétrons têm um raio e uma. Para explicar a evidente estabilidade do átomo de hidrogênio e, de quebra, a aparência das séries de linhas espectrais desse elemento, Bohr propôs alguns postulados. Como o moledo do hidrogênio do Bohr explica espectros de emissão atômicos Se você está vendo esta mensagem, significa que estamos tendo problemas para carregar recursos externos em nosso website.
Teoria de Bohr para o átomo de hidrogênio Segundo o que foi explicado no modelo atômico de Rutherfor este descrevia o átomo como constituído por uma região central muito pequena, o núcleo, carregado positivamente e ao redor do qual os elétrons carregados negativamente ocupam uma região muito maior. Por conta disso, o nome dado a esse modelo atômico é Modelo Atômico de Bohr ou Modelo Atômico de Rutherford- Bohr ! Foram analisadas as seguintes concepções atômicas: Os elétrons, que giram ao redor do núcleo não giram por acaso, porém, permitem descrever órbitas bem determinadas! O átomo é um elemento realmente muito pequeno, e. Além disso, os valores de energia são negativos, o que significa que o elétron precisa receber energia para chegar ao nível, deixando de interagir com o núcleo nesse momento, ou perdendo o vínculo com o átomo. Bohr também postulou que todo átomo, ao passar de um estado estacionário para outro, emite ou absorve um quantum de energia.
Bohr vídeos timer min Neste módulo de física você vai aprender tudo sobre o Átomo de Bohr , entender de que forma ele é aplicado no mundo da física e ver exemplos práticos para facilitar o seu entendimento. Bohr describió el átomo de hidrógeno con un protón en el núcleo, y girando a su alrededor un electrón. Para explicar a estabilidade do átomo, o físico dinamarquês Niels Bohr admitiu que um gás emite luz quando uma corrente elétrica passa através deste, devido aos elétrons em seus átomos primeiro absorverem energia da eletricidade e posteriormente liberarem aquela energia na forma de luz. Portadores de la carga positiva, los protones son parte del núcleo y aportan casi la mitad de la masa de un átomo. Con ligeramente menos masa que los neutrones, los protones tienen una masa de 1. O modelo atômico de Rutherford- Bohr ficou assim conhecido porque Bohr manteve as principais características do modelo de Rutherford.
La masa de un protón es 99.