Bohr chegou a esse modelo baseando-se no dilema do átomo estável. Ele acreditava na existência de princípios físicos que descrevessem os elétrons existentes nos átomos. Química do Sucesso com o Prof. O Modelo Atômico de Bohr apresenta o aspecto de órbitas onde existem elétrons e, no seu centro, um pequeno núcleo.

Ele preencheu a lacuna que existia na teoria atômica proposta por Rutherford. Segue abaixo um desenvolvimento do modelo de Bohr que demonstra os níveis de energia no hidrogênio. Sejam as seguintes convenções: 1. Em tais órbitas os elétrons não poderiam permanecer e acabariam por emitir a energia excedente no traslado de um nível para o outro. Apesar de conseguir explicar o movimento do elétron no átomo de hidrogênio, o modelo proposto por Bohr não obteve o mesmo resultado quando aplicado a átomos de outros elementos, não sanando o problema da estrutura atômica.
A partir dos estudos de Rutherford e da teoria da mecânica quântica de Max Planck, Bohr estabeleceu o modelo atômico que lhe valeria o reconhecimento posterior. Niels Bohr apresentou a ideia de que os elétrons giram ao redor do núcleo em órbitas determinadas, mas quando a eletricidade passa através do átomo, o elétron pula para a. Estudou ainda o modelo nuclear da gota líquida e, antes da descoberta do plutónio, previu a propriedade da fissão nuclear, análoga à do urânio-235. Históricamente el desarrollo del modelo atómico de Bohr junto con la dualidad onda-corpúsculo permitiría a Erwin Schrödinger descubrir la ecuación fundamental de la mecánica cuántica. Influência do Modelo de Bohr. Enquanto o modelo de Bohr se mostrou inovador em alguns aspectos – a fusão Ryberg de constante e constante de Planck (aka teoria quântica.) Com o modelo de Rutherford – ele fez sofrer de algumas falhas que mais tarde experimentos que ilustram.
Para começar, supunha-se que os elétrons têm um raio e uma. Esse modelo embora ainda não “funcionasse” para átomos mais pesados, explicou com perfeição os fenômenos como o espectro de emissão e absorção do. Para explicar os erros do modelo anterior, Bohr sugeriu que o átomo possui energia quantizada. Cada elétron só pode ter determinada quantidade de energia, por isso ele é quantizada.
El modelo establece que el electrón se desplaza en órbitas a una distancia fija alrededor del núcleo atómico, describiendo un movimiento circular uniforme. Niels Bohr , físico dinamarquês, foi quem propôs o primeiro modelo quântico do átomo. Niels Bohr relacionou os espectros de linhas dos elementos, principalmente o do hidrogênio, com a constituição do átomo. O modelo de Bohr representa os níveis de energia. Thomson foi o primeiro a observar e estudar o elétron, influenciado pelos trabalhos de Maxwell e pelo descobrimento do raio X ele pesquisou a relação entre sua massa e carga.
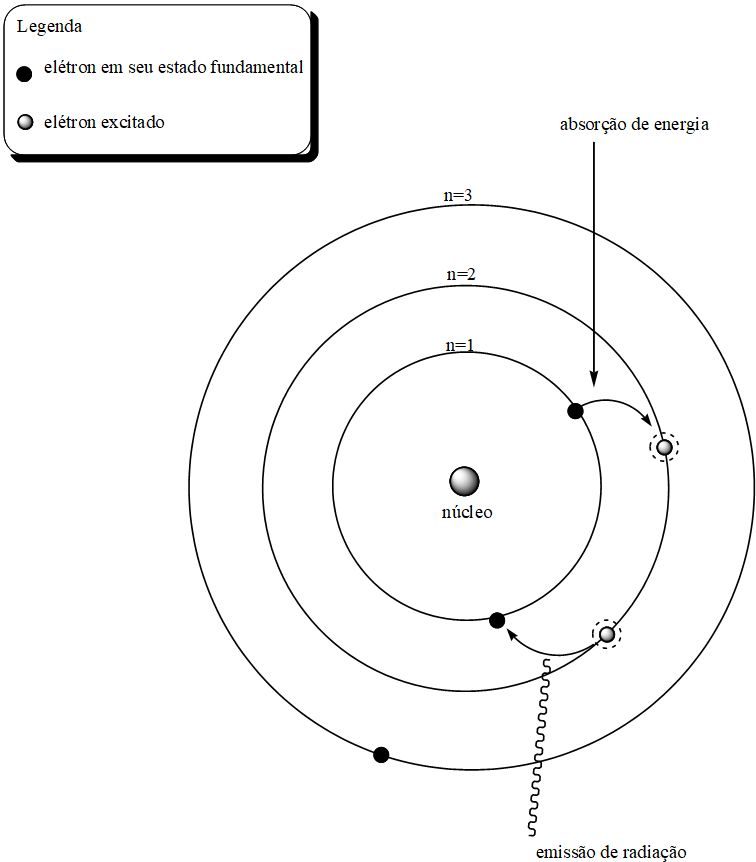
Niels Bohr aprensentou alguns postulados que solucionavam a instabilidade do modelo atômico proposto por Rutherford. Nomes: Seu modelo estava baseado em dois postulados: 1º. Os elétrons só podem girar ao redor do núcleo em órbitas circulares, essas órbitas são chamadas de órbitas estacionárias e enquanto eles estão nessas órbitas, não emitem energia. O espectro atômico do átomo de Hidrogênio foi finalmente explicado por Niels Bohr e seu modelo atômico.
Bohr dedicou-se também ao estudo do núcleo atómico. Bohr descobriu que durante a fissão de um átomo de urânio desprendia-se uma enorme. Bohr desenvolveu o modelo de Bohr do átomo, no qual ele propôs que os níveis de energia dos elétrons são discretos e que os elétrons giram em órbitas estáveis ao redor do núcleo atômico, mas podem pular de um nível de energia (ou órbita) para outro.
Niels Bohr sabía que las principales objeciones al modelo atómico de Rutherford eran que, de acuerdo a las leyes electromagnéticas de Maxwell, los electrones irradiarían su energía en forma de ondas electromagnéticas y, por lo tanto, describirían órbitas espirales que los irían acercando al núcleo hasta chocar contra él. Seu trabalho partiu do modelo atômico de Rutherfor segundo o qual o átomo é formado por um núcleo compacto cercado por uma nuvem de elétrons mais leves. Quando o elétron é excitado por radiação, por exemplo, absorve energia e forma de fótons, porém para que este mude de camada, o fóton deve conter exatamente a diferença de energia entre os níveis, quando isso ocorre o elétron muda de camada. Se a energia do fóton for suficiente, o elétron pode inclusive deixar o átomo. O legado de Niels Bohr.
A próxima grande evolução na compreensão da estrutura do átomo veio com o modelo atômico de Niels Bohr. Todavia, devido à grande sofisticação matemática deste modelo e dos que o sucederam, a plena compreensão mais sofisticada da estrutura da matéria ficou restrita a um grupo cada vez mais seleto de cientistas. Há cem anos o físico dinamarquês Niels Bohr publicava um dos mais importantes trabalhos da física do século vinte. Teoria de Bohr para o átomo de hidrogênio Segundo o que foi explicado no modelo atômico de Rutherfor este descrevia o átomo como constituído por uma região central muito pequena, o núcleo, carregado positivamente e ao redor do qual os elétrons carregados negativamente ocupam uma região muito maior.
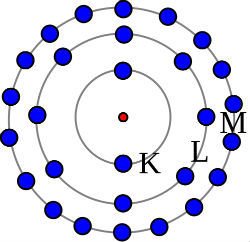
Neste modelo , Bohr mencionou que a maior parte da massa atômica está no núcleo central que contém prótons e elétrons estão dispostos em níveis de energia definidos e giram em torno do núcleo. Esse modelo , também conhecido como modelo quântico, é baseado na teoria quântica de Max Planck, que diz que a energia é liberada na. Baseado na teoria quântica, Bohr explicou o comportamento dos elétrons nos átomos. Bohr criou um novo modelo atômico, fundamentado na teoria dos quanta de Max Planck, estabelecendo alguns. Postulados do modelo atômico de Bohr Enunciado.
El Modelo Atómico de Bohr explica las insuficiencias del Modelo Atómico de Rutherford sobre la estabilidad de las órbitas del electrón y la existencia de espectros de emisión característicos. El modelo de Bohr incorpora también la teoría del efecto fotoeléctrico de Einstein. Como isso não ocorria, pelo átomo ser uma estrutura estável, o cientista dinamarquês Niels Bohr aperfeiçoou o modelo proposto por Rutherfor formulando sua teoria sobre distribuição e movimento dos elétrons.
O seu modelo baseia-se no Sistema Solar, no qual os planetas giram ao redor do Sol. Para Bohr , os elétrons giram em órbita ao redor do núcleo atômico agrupados em níveis energéticos. Historicamente, o desenvolvemento do modelo atómico de Bohr xunto coa dualidade onda-corpúsculo permitiría a Erwin Schrödinger descubrir a ecuación fundamental da mecánica cuántica.
Vamos ver quais eram os princípios fundamentais desse modelo ? Os problemas com o modelo do átomo de Rutherford foram resolvidos de uma forma surpreendente pelo jovem físico dinamarquês Niels Bohr. O seu ficou popular e conhecido como Modelo Atômico de Thomson, o “pudim de passas”. No ano seguinte, Bohr passou a trabalhar no laboratório do professor Ernest Rutherfor em Manchester.