As máquinas térmicas foram o grande incentivo para que os estudos e , consequentemente, as leis da termodinâmica evoluíssem. O grande desafio era criar máquinas cada vez mais eficientes. O calor não pode fluir, de forma espontânea, de um corpo de temperatura menor, para um outro corpo de temperatura mais alta. Tendo como consequência que o sentido natural do fluxo de calor é da temperatura mais alta para a mais baixa, e que para que o fluxo seja inverso é necessário que um agente externo realize um trabalho sobre este sistema. Isso quer dizer que ela indica as trocas de calor que têm tendência para igualar temperaturas diferentes (equilíbrio térmico), o que acontece de forma espontânea.
A segunda lei da termodinâmica é um princípio geral que impõe restrições sobre a direção da transferência de calor e as eficiências atingíveis de motores térmicos. Terceira Lei da Termodinâmica A Terceira Lei da Termodinâmica surge como uma tentativa de estabelecer um ponto de referência absoluto que determine a entropia. Isso, mudaria completamente a compreensão do calor como forma de energia e ampliou o campo de atuação da termodinâmica.
Em geral, estudantes de engenharia, tecnologia e de diversos outros cursos provavelmente já tiveram alguma disciplina que envolvesse o termo termodinâmica. No caso da 2ª lei da termodinâmica dependendo do curso, é rara as vezes em que o professor consegue introduzir e finalizar todo o conteúdo desse assunto. Porém, se lembrarmos dos refrigerados, veremos que é isto que acontece. Nestes sistemas, a troca de calor não é espontânea. Primeira Lei da Termodinâmica.

Se você continua tendo problemas, verifique o relógio de seu computador e certifique-se de que a data de hoje esteja definida corretamente. Ao fazê-lo, ele vai além das limitações impostas pela primeira lei da termodinâmica. O conceito de temperatura entra na termodinâmica como uma quantidade matemática precisa que relaciona calor e entropia. A interação entre essas três quantidades é descrita pela terceira lei da termodinâmica, segundo a qual é impossível reduzir qualquer sistema à temperatura do zero absoluto mediante um número finito de operações. De acordo com a primeira lei da termodinâmica, conhecida como sendo o princípio de conservação da energia, se um sistema trocar calor com outro, a sua própria energia interna irá mudar.
Não se está sujeito a segunda lei , porque a entropia só ocorre em ambientes fechados, a Terra e os que a habitam não entram nesse grupo, Já que recebemos constantemente energia do sol. A primeira lei trata então da possibilidade do aproveitamento para os mais diversos fins. Como nem tudo são flores, a segunda lei apresenta alguns argumentos sobre algumas impossibilidades da utilização plena de energia. A entropia está diretamente relacionada a segunda lei da termodinâmica , por isso, vamos falar dela agora. Podemos evidenciar isso com um experimento muito simples.
O que significa entropia? Se colocarmos um prato de comida que acabou de sair do forno sobre a mesa iremos verificar que com o tempo o calor é transferido da comida para o ambiente, esfriando nosso alimento. Noções Preliminares Muitas vezes é oferecida ao estudante de Física a seguinte proposta: “considere um sistema”. O sistema é algo sobre o qual devemos focalizar nossas atenções – um pedaço do Universo cujas características e comportamento deveríamos nos esforçar para entender.
Se você está vendo esta mensagem, significa que estamos tendo problemas para carregar recursos externos em nosso website. A variação da energia interna DU é medida pela diferença entre a quantidade de calor (Q), trocado pelo sistema com seu exterior, e o trabalho realizado (W) e é dada pela expressão DU = K – W , que corresponde ao enunciado da lei da termodinâmica. Analiticamente: ΔU = Q – W. A Segunda Lei da Termodinâmica descreve princípios básicos familiares à vida cotidiana. Ela é parcialmente uma lei universal de deterioração, a causa final por que todas as coisas finalmente caem aos pedaços e se desintegram com o tempo. A sua segunda lei é relatada por um grande físico que faz restrições para cada transformação realizada pelas máquinas térmicas, como o motor da sua geladeira de casa.
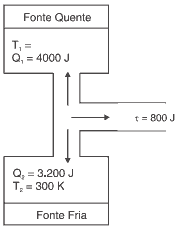
A lei zero da termodinâmica Se dois sistemas estão separadamente em equilíbrio térmico com um terceiro, então eles também devem estar em equilíbrio térmico um com o outro. A eficiência ( e ) de uma máquina frigorífica é expressa pela relação entre a quantidade de calor retirada da fonte fria (Q ) e o trabalho externo (W) envolvido nessa transferência. C ar, oC Vapor oC ar, oC sat. Na experiência de Joule, quando no final a água no recipiente fica a uma temperatura superior, a entropia da água é por definição maior.
A transformação é irreversível, um objecto cai, causando a agitação das pás, que por sua vez provocam o aumento da temperatura da água. A utilização direta desses princípios em motores de combustão interna ou. Basicamente a primeira lei nos afirma que a energia desse sistema é conservada quando analisada somente entre estados de equilíbrio.
E existe a famigerada Segunda Lei da Termodinâmica, que iremos discutir daqui em diante. Refrigeradores comuns eat and Thermodynamics, Zemansky. Lei da Termodinâmica Enunciado de Clausius Nenhum processo cujo único resultado seja a transferência de calor de um corpo a uma temperatura inferior para outro a uma temperatura superior é possível. Assim, o enfoque fundamental de todo o desenvolvimento teórico, que culminou com o aparecimento de uma lei da Termodinâmica, foi o aumento na eficiência.
A resposta a todas as questões acima é dada pela Segunda Lei da Termodinâmica. Existem algumas formulações sobre a segunda lei ( e todas são equivalentes). Quando o volume de um sistema é constante o trabalho é nulo (W = 0), logo, a variação da energia interna do sistema depende do calor que o sistema recebe ou cede.
AssiEi= Q Esta transformação é típica de situações em que se verifique o aquecimento ou arrefecimento de um líquido num sistema fechado com fronteira rígida.