Energia interna de um sistema (U) é a soma das energias cinética e potencial das partículas que constituem um gás. Esta energia é uma característica do estado termodinâmico e deve ser considerada como mais uma variável que pode ser expressa em termos de pressão, volume, temperatura e número de mols. Hoje sabe-se que a energia interna de um gás real depende da pressão ou do volume, assim como da temperatura. Entretanto, a dependência da pressão e do volume é muito pequena, e a dependência com a temperatura é muito alta.
Quando a temperatura de um gás aumenta ou diminui, significa que este gás ganhou ou perdeu energia. Nesta aula é apresentado o conceito de Energia Interna de um Gás Ideal, e suas relações. Se é energia que a molécula possui essa energia vai variar de molécula para molécula?
Pois uma molécula monoatômica tem menos graus de liberdade que uma. Um exemplo para entender o que é energia interna que encontramos em armas nucleares. A energia liberada pelas armas nucleares é uma parte muito pequena da sua energia interna. No entanto, eles emitem uma tremenda energia e têm grande devastação. Você sabe o que é energia interna ? Chamamos de energia interna toda a energia contida em um sistema termodinâmico, ou seja, a soma das energias cinética e potencial para cada átomo ou.
Para que este somatório seja calculado, são consideradas as energias cinéticas de agitação , potencial de agregação, de ligação e nuclear entre as partículas. A partir das afirmações acima, podemos concluir que , a energia interna de certo número de mols de um gás perfeito, é totalmente dependente da temperatura, e que a energia interna de um determinado número de mols de um gás perfeito, é diretamente proporcional à temperatura absoluta do gás. Simulado matérias específicas de Química com gabarito. Durante um ciclo completo, a variação da energia interna é nula. Um fato importante de falarmos nesse tema, é que está intimamente ligado ao trabalho de uma força, bem como a temperatura, volume e energia interna de um gás perfeito.
No estudo da termodinâmica temos que , para um determinado gás , podemos calcular o trabalho da força exercida por ele. Para el caso de un gas ideal puede demostrarse que la energía interna depende exclusivamente de la temperatura, ya en un gas ideal se desprecia toda interacción entre las moléculas o átomos que lo constituyen, por lo que la energía interna es sólo energía cinética, que depende sólo de la temperatura. A energia de um sistema termodinâmico, composto por um grande número de partículas tais como íons, moléculas, átomos ou mesmo fótons, pode ser decomposta em três partes: As energias cinéticas atreladas ao movimento de todo o sistema e ao movimento das partículas que o constituem. A energia interna de um gás depende da quantidade de mols do gás e da sua temperatura absoluta, dada em Kelvin. Assim, podemos dizer que se o gás recebe calor e mantém o volume constante, o calor que ele recebeu foi transformado em energia interna , pois houve aumento na temperatura.
Agora, caso o gás mantenha o mesmo volume mesmo ao ser resfriado, dizemos que o calor que ele perdeu foi igual à perda de energia interna. Uma parede isolada é bastante próxima de um limite adiabático. Daí aparece o termo da parede adiabática. Um processo que não envolve a transferência de calor ou matéria dentro ou fora de um sistema, de modo que Q = é chamado de processo adiabático, e dizia que esse sistema era isolado adiabáticamente.
Essa energia está distribuída entre as partículas que formam o sistema e entre as diversas formas em que cada partícula pode armazená-la. Portanto gases ideais são os únicos que não diminuem sua temperatura quando se expandem livremente. Temperatura, energia interna e equilíbrio térmico são conceitos que fazem parte da teoria cinético – molecular da matéria e só podem ser compreendidos se considerarmos a ideia de que a matéria é constituída de moléculas em movimento.
Para uma determinada substância, o grau de agitação( energia cinética média) de suas moléculas. Agora considere o fornecimento de uma determinada quantidade de calor q ao sistema, que realizará um trabalho τ sobre o meio ambiente. Conforme a primeira lei da Termodinâmica quando realizamos um trabalho sobre o gás, comprimindo- o , ou se cedemos calor ao gás, ele recebe energia que conserva como. Quando um gás sofre uma transformação de modo que o estado final coincide com o inicial, dizemos que a transformação foi cíclica ou que o gás realizou um ciclo.
Como exemplo temos o caso da Fig. Nesse caso o gás saiu do estado A, e no final voltou ao estado A. Neste caso devemos usar a equação da energia interna juntamente com a equação de Clapeyron, assiTrabalho de um gás. Quando são colocados moles de um gás em um recipiente com êmbolo que mantém a pressão igual a da atmosfera, inicialmente ocupando 2m³. Ao empurrar-se o êmbolo, o volume ocupado passa a ser 1m³. Denomina-se transformação cíclica ou ciclo de um sistema o conjunto de transformações sofridas pelo sistema de tal forma que seus estados final e inicial sejam iguais.
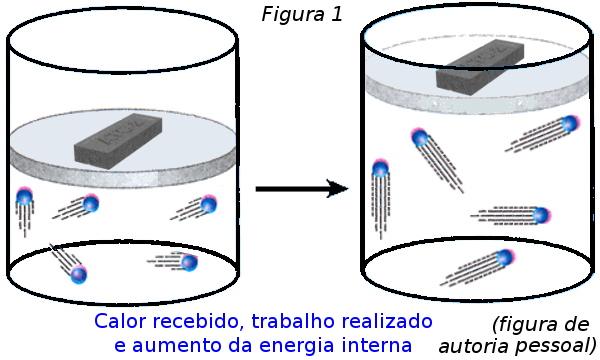
Questoes resolvidas de termodinmica 1. EXERCICIOSDE REVISÃO Questões resolvidas de vestibulares de Termodinâmica Questões resolvidas de vestibulares sobre 1ª e 2ª Lei da Termodinâmica, Energia Interna , Ciclo de Cannot e trabalho de um gás 1) Ao receber uma quantidade de calor Q=50J, um gás realiza um trabalho igual a 12J, sabendo que a Energia interna do sistema antes de receber calor. Considere que o motorista perde calor a uma taxa constante de 1joules por segundo e que o aquecimento do ar confinado se deva exclusivamente ao calor emanado pelo motorista. Logo para um sistema onde há um aumento de temperatura, também haverá um aumento na energia interna e com isso o volume do gás que está preso dentro do recipiente também aumentará.
Um bom exemplo desse aumento da energia interna é quando colocamos ar no embolo e depois o comprensamos ao máximo, o gás que está lá dentro se expandirá. Blog do Enem Física – Termologia: Trabalho em sistemas e energia interna. Si pensamos en constituyentes atómicos o moleculares, será el resultado de la suma de la energía cinética de las moléculas o átomos que constituyen el sistema ( de sus energías de traslación, rotación y vibración) y de la energía potencial intermolecular (debida a las fuerzas intermoleculares) e intramolecular de la energía de enlace.

Se você está vendo esta mensagem, significa que estamos tendo problemas para carregar recursos externos em nosso website.