Isso porque, um número maior de colisões aumenta a probabilidade de formação do complexo ativado, que, por sua vez, permite que ocorra a reação. Os átomos das moléculas dos reagentes estão sempre em movimento, gerando muitas colisões (choques). Parte destas colisões aumentam a velocidade da reação química.
Quanto mais choques com energia e geometria adequada houver, maior a velocidade da reação. Confira o que é energia de ativação, complexo ativado, os. TEORIA DAS COLISÕES : Uma reação química ocorre através das colisões entre as substâncias reagentes. Mas essa colisão não pode ser um simples contato entre as moléculas. Para garantir a ocorrência da reação, temos que ter a colisão eficaz ou efetiva, entre os reagentes.
Qualitativamente falando, ela explica a forma que reações químicas ocorrem. Contudo, resumem quais as taxas de reação acabam diferenciando para diferentes reações. A teoria das colisões está intimamente relacionada com a cinética química.
Taxa de reação tende a aumentar com a concentração – um fenômeno explicado pela teoria das colisões. Este artigo ou seção está a ser traduzido de Collision theory na pédia em inglês. Destaque Para onde irão os médicos do Brasil? Tal movimento dá origem à colisão, e a partir dessa colisão pode ocorrer a reação. De acordo com a teoria de colisões , para que uma reação química ocorra são necessários: a. Qualquer tipo de choque entre os reagentes sem necessidade de energia.
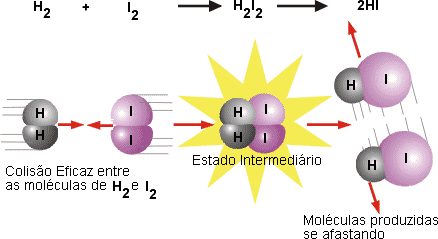
Durante a colisão, a energia cinética que uma molécula possui pode ser usada para esticar, dobrar e quebrar ligações, levando a reações químicas. Desse modo, como resultado da teoria das colisões , aumenta a probabilidade de as moléculas reagirem — ou seja, aumenta a velocidade da reação. Exercícios sobre Colisões Exercícios de Física Teste os seus conhecimentos: Faça exercícios sobre Colisões e veja a resolução comentada. A fi gura I mostra a aproximação entre as moléculas, que se chocam com geometria favorável e energia sufi ciente e formam o complexo ativado em II.
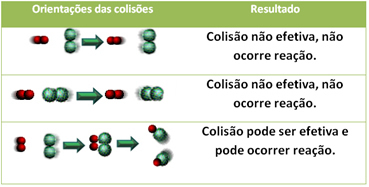
Ela determina que para a reação química acontecer os reagentes devem estar em contato, através de colisões. Entretanto, apenas isso não garante que a reação ocorra. Também é preciso que as colisões sejam efetivas (orientadas). Exercícios sobre condições para ocorrência de reações químicas Estes exercícios sobre condições para ocorrência de reações químicas abordam caraterísticas como colisões , afinidade, energia de ativação e contato entre reagentes. Esta teoria está enquadrada num ramo da Química que estuda a velocidade das reacções bem como os factores que a influenciam – a cinética química.
De uma maneira geral, podemos representar as reações químicas pelos gráficos a seguir: 1º) Para que ocorra a reação é necessário que as moléculas reagentes colidam entre si. Tem mais depois da publicidade 
Sempre que houver uma interação entre dois corpos, sendo que, ao menos um deles esteja em movimento, ou adquira movimento, a determinação da quantidade de movimento e do impulso é importante. A decomposição da água oxigenada é acelerada por uma enzima presente no sangue que atua como catalisadora dessa reação. Teoria das colisões : Não pare agora.
As colisões são perfeitamente elásticas. As moléculas se movem em linha reta entre as colisões. O diâmetro das moléculas é desprezível em comparação com a distância percorrida entre as.
Caso eles não entrem em contato, a reação não acontece. Para que uma reação ocorra é necessário que os reagentes entrem em contato. A velocidade está relacionada à orientação das colisões e ao número de colisões. Nem toda colisão, porém, é eficaz, pois é necessário que haja energia suficiente e geometria molecular adequada.
Por exemplo, uma explosão pode ocorrer em menos de um segundo, a cocção de um alimento pode levar minutos ou horas, a corrosão pode levar anos, e a erosão de uma rocha pode ocorrer em milhares ou milhões de anos. No módulo de cinética química, você aprenderá a analisar a velocidade das reações químicas. Inicialmente, você conhecerá alguns conceitos gerais como velocidade de consumo ou formação, teoria das colisões , energia de ativação, complexo ativado e cálculo da velocidade média da reação.

Ela é vista pelos físicos como a principal teoria que possa explicar o universo inteiro, desde o surgimento do Big Bang até o possível fim do universo. A teoria de estado de transição aperfeiçoa a teoria das colisões ao indicar um modo de calcular a constante de velocidade mesmo quando as exigências esteáricas são significativas. UNIVERSIDADE ESTADUAL DE PONTA GROSSA SETOR DE CIÊNCIAS EXATAS E NATURAIS DEPARTAMENTO DE QUÍMICA Willian Rafael Rodrigues do Prado R.