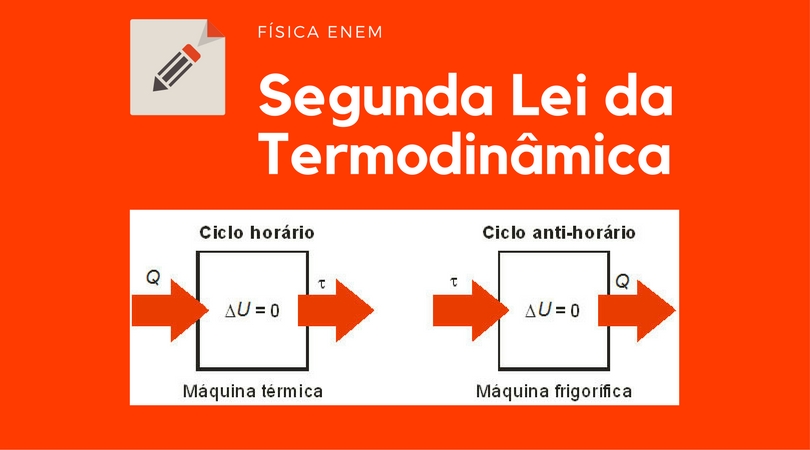
O processo inverso, ou seja, transformar o calor em trabalho não é tão simples e está sujeito a certas restrições. Dessas restrições veio a segunda lei da termodinâmica que pode ser enunciada da seguinte forma: Não é possível construir uma máquina térmica que transforme integralmente o calor em trabalho. O trabalho identifica o momento em que a força é feita uma mudança. Unbeatable Earns GOLDEN BUZZER From Dwyane Wade! A cada ciclo é retirada uma quantidade de calor da fonte quente, que é parcialmente convertida em trabalho , e a quantidade de calor restante é rejeitada para a fonte fria.
Terceira Lei da termodinâmica. A termodinâmica é uma área da Física que estuda as transferências de energia. Busca compreender as relações entre calor , energia e trabalho , analisando quantidades de calor trocadas e os trabalhos realizados em um processo físico. Vimos que trabalho e calor são duas formas de mudarmos a energia de um sistema. Se um sistema recebe calor , sua energia tende a aumentar.
Mas pense agora no papel do trabalho. Para que você, com seus músculos, realize um trabalho , é necessário gastar sua energia química armazenada nas células. Expresse as respostas em. Considere um gás de massa m contido em um cilindro com área de base A, provido de um êmbolo.
Ao ser fornecida uma quantidade de calor Q ao sistema, este sofrerá uma expansão, sob pressão constante, como é garantido pela Lei de Gay-Lussac, e o êmbolo será deslocado. Calor específico e calor latente de fusão e de vaporização O que o calor significa na termodinâmica e como podemos calcular o calor usando a capacidade térmica. Se você está vendo esta mensagem, significa que estamos tendo problemas para carregar recursos externos em nosso website. A sua segunda lei é relatada por um grande físico que faz restrições para cada transformação realizada pelas máquinas térmicas, como o motor da sua geladeira de casa.
Ou seja, ela estuda como a variação da temperatura, da pressão e do volume interfere nos sistemas físicos. Tabela com alguns Calores Específicos e Calores Específicos Molares à Temperatura Ambiente. Calor em termos de Trabalho sem problemas lógicos: “ Calor é toda interação entre um sistema e seu meio que não é trabalho ”. Vê-se assim que, de fato, a definição de trabalho apresentada no item anterior inclui todos os tipos de. Não há calor , e a única forma de se fazer a energia interna variar é mediante a realização de trabalho.
Ou seja, na transformação isotérmica todo calor cedido pelo meio é transformado em trabalho de expansão do gás e , mesmo não havendo variação de temperatura, há troca de calor com o meio. J para o fluxo de sangue e 1. Trabalho e calor são altamente inter-relacionados, mas não são exatamente os mesmos. Com estes dois conceitos limpos, a termodinâmica clássica tornou-se um dos campos concluídos na física.
Tanto o calor quanto o trabalho são conceitos de energia. Vamos aprender sobre a transferência de energia durante alterações físicas e químicas, e como podemos prever que tipo de alterações vão ocorrer. A relação, , entre trabalho e calor constitui o 1º princípio da termodinâmica ou o princípio da conservação da energia”.
A relação mostra que trabalho e calor são forma distintos da mesma entidade, a que se denomina energia, e que esta se conserva em todas as transformações”. Numa transformação isocórica, a variação da energia do gás é igual à quantidade de calor trocada com o meio exterior. Numa expansão isobárica, a quantidade de calor recebida é menor que o trabalho realizado.
A) I e II estão corretas. B) II e III estão corretas. C) I e III estão corretas. D) Todas estão corretas.
CALOR E TRABALHO META Fazer com que o estudante comece a pensar no ensino de ciências como algo orgânico que está em profunda transformação. Fazer com que os alunos percebam, através de um texto básico complementado com atividades lúdicas, applets de ensino, vídeos, que o conceito de calor e trabalho podem ser apreendido de forma simples e divertida. A energia interna de um sistema pode ser modificada exercitando-se um trabalho sobre ele ou aquecendo-o (fornecendo energia térmica). Se olharmos para a primeira lei da termodinâmica, vemos que isso postula que o aumento da energia interna é igual ao calor total somado ao trabalho feito pelo ambiente. Se o sistema estiver isolado, sua.
Essa conservação de energia acontece sob as formas de calor e de trabalho. Ela faz com que um sistema possa conservar e transferir energia, ou seja, a energia pode sofrer aumento, diminuição ou permanecer constante. A Primeira Lei da Termodinâmica é expressa pela fórmula. Onde, Q: calor τ: trabalho ΔU: variação da. E esta conservação existe como forma de calor e trabalho.
A conservação de energia faz com que o sistema num todo, conserve e ao mesmo tempo, transfira energia. Isso quer dizer que a energia pode ter aumento, diminuição e permanência constante ao mesmo tempo, ou seja, o calor resulta da soma do trabalho com a variação interna de energia. Nesse caso, temos uma transformação da energia mecânica em calor. Esse é só um dos muitos exemplos que ocorrem frequentemente ao nosso redor.
O calor e trabalho tem significado apenas enquanto ocorre transferência de energia para um sistema, somando -se ou subtraindo -se energia interna total. Observando o Calor e Trabalho. Para entendermos melhor como o calor e trabalho são trocados com o ambiente vamos considerar como sistema um gás.
Considere que o motorista perde calor a uma taxa constante de 1joules por segundo e que o aquecimento do ar confinado se deva exclusivamente ao calor emanado pelo motorista.