MUDANÇA DE ESTADO e DIAGRAMA DE FASE – TERMOLOGIA – Aula – Prof. Termodinâmica – Mudança de Estado de um Gás – Exercício. Química em Ação com Prof. Paulo Valim 232views. A figura mostra o nome que se dá às transições de fase: Fusão: passagem da fase sólida para a líquida.

Para qualquer sistema que sofre uma mudança de estado como ocorre na Figura 10. A mobilidade dos átomos da maior parte dos sólidos é bastante baixa. Sendo assim, a maioria dos sólidos de uso comum não está dentro do equilíbrio termodinâmico, se limitando, em alguns casos, a estarem quase no equilíbrio.
Existem duas maneiras de utilizar a palavra “ estado ” dentro dessa disciplina. Finalmente, decimos que un sistema ha alcanzado el estado de equilibrio cuando sus variables de estado permanecen constantes. Todas las propiedades del sistema en equilibrio quedan determinadas por factores intrínsecos y no por influencias externas previamente aplicadas.
La termodinámica sólo se ocupa de sistemas en estado de equilibrio. A abordagem através de estados de equilíbrio termodinâmico do sistema requer um relato completo do estado do sistema, bem como a noção de processo a partir de um estado para outro de um sistema, mas pode necessitar de apenas uma conta idealizada ou parcial, do estado do entorno do sistema ou de outros sistemas. As funções de estado descrevem a condição momentânea de um sistema termodinâmico. Isso significa que as mudanças incrementais nessas variáveis são diferenciais exatos. Uma transformação termodinâmica (ou processo termodinâmico) é uma mudança de estado do sistema de um estado de equilíbrio para outro estado de equilíbrio.
A mudança pode acontecer por uma ação externa ou pela remoção de um vínculo interno dentro do sistema. Podemos também variar o estado do sistema colocando-o em contato térmico com outro sistema cuja temperatura esteja diferente. Assim, há certa quantidade de energia em trânsito, que se desloca do sistema de maior valor Q para o menor, fazendo com que haja um aumento da energia interna do sistema inicialmente com menor quantidade de energia. Se a transferência de calor resultar em uma mudança no estado de agregação, esse calor recebe o nome de calor latente, enquanto que, se a transferência de calor resultar em uma diminuição na diferença de temperatura (porque os dois sistemas ou dois partes do mesmo sistema tendem a atingir o equilíbrio térmico) falamos de calor sensível. As transformações de estado físico da matéria apresentam denominações características, como se pode ver abaixo: a) FUSÃO: representa a passagem do estado sólido para o estado.
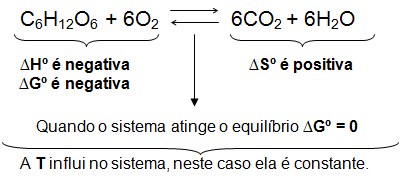
Mudanças de estado físico A temperatura permanece constante durante tora mudança de estado , desde que a pressão permaneça constante. Mudança de Estado Quando qualquer propriedade do sistema é alterada houve uma mudança de estado no sistema termodinâmico. Processo – É a maneira como ocorre a mudança de estado , definida pela sucessão de estados através dos quais o sistema passa. Quase todos os corpos, com o aumento de temperatura, se comportam como a água, ou seja, passam do estado sólido ao, líquido e então ao gasoso. Toda mudança de estado é acompanhada de absorção ou de liberação o de energia.
Na fusão de um sólido e na evaporação de um líquido há recebimento de energia do exterior. Processo de quase-equilíbrio: Consideremos o equilíbrio do sistema mostrado abaixo quando ocorre uma mudança de estado. No instante em que o peso é removido, o equilíbrio mecânico deixa de existir, resultando no movimento do pistão para cima, até que o equilíbrio mecânico seja restabelecido.
Térmica, atuando principalmente nos seguintes temas: mudança de fase líquido-vapor, uso e processamento de gás natural,. Equação de Estado , Gás Perfeito. Então é preciso, para identifi car o estado termodinâmico, mais uma propriedade independente. Um cubo de 0kg de gelo acha-se no interior de um recipiente de alumínio, de massa 0kg, ambos inicialmente a -10°C. Através de um aquecedor com potência de 0kW, o gelo é aquecido, transformando-se em vapor a 100°C, sob pressão normal.
A densidade de uma substância (ρ) equivale a sua massa por unidade de volume, e também representa o estado de agregação de uma substância. Para casos reais, são necessários três eixos para as variáveis p, V e T. Com uma mudança de estado , somos movidos ao longo de uma curva tridimensional pela superfície no espaço p, V e T. Perceba que não se está falando de mudança de estado de agregação do sistema (sólido, líquido, gasoso). A relação matemática entre as variáveis de estado designa-se por equação de estado , a qual permite prever o comportamento do sistema face à alteração de uma ou mais variáveis de estado. O estado termodinâmico de um sistema é então definido, especificando certas variáveis de estado e as correspondentes equações de estado.
A Primeira Lei para Mudança de Estado de um Sistema. Trabalho e calor somente aparecem como fenômenos de fronteira, como fluxo, de forma que é impróprio dizer-se que um sistema “possui” trabalho ou calor. Quando a propriedade termodinâmica de um sistema de modifica ocorre necessariamente uma mudança de estado ou processo termodinâmico.
Além disso, mudanças de estado podem ocorrer mesmo que uma das propriedades se mantenha constante. Esses tipos de processos possuem denominações especiais. O processo ideal sem perdas, do ponto de vista. A entropia é uma função de estado , uma propriedade cujo valor só depende do estado presente no sistema. Como essa desordem foi alcançada não é importante para o seu valor.
A termodinâmica estuda a transformação de uma forma de energia em outra, e envolve: As trocas de energia que acompanham os processos físicos (como mudança de estado sólido-líquido e líquido-gás, variação de temperatura, pressão e volume) e nos processos químicos (trocas de energia em reações químicas). O estado de equilíbrio foi de nido como o estado que o sistema atinge após um tempo longo e não se altera mais. Portanto, é necessário associar uma outra grandeza termodinâmica ao sistema que caracteriza o estado de equilíbrio. Mas existe outra variável significativa nesse fenômeno: a pressão. Um aumento de pressão tende a aproximar as partículas que formam um sistema, assim como uma diminuição de pressão faria o inverso.
Em sistemas de um componente e de uma fase, a equação de estado incluirá três propriedades, duas das quais podem ser consideradas como independentes.