Quando houver aumento da temperatura absoluta ocorrerá uma variação positiva da energia interna. Quando houver diminuição da temperatura absoluta, há uma variação negativa de energia interna. E quando não houver variação na temperatura do gás, a variação da energia interna será igual a zero. Com esses dados podemos determinar a variação da energia interna , que será: ΔU = 4. U = 37J Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás.
Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre. Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. A 1ª Lei da termodinâmica estabelece que a variação da energia interna de um sistema corresponde à energia térmica (Q) recebida pelo sistema na forma de calor menos a energia cedida pelo sistema à sua vizinhança na forma de trabalho (W). Variação da energia interna em termos da variação de volume do gás. Energia interna para gases diatômicos Para os gases diatômicos ideais, a energia interna é dada por uma equação um.
Assim, podemos dizer que a energia interna de um sistema varia diretamente com a temperatura. Exceto nas mudanças de estado. A variação de energia interna é independente dos estados intermediários. Importante: Em um ciclo, a variação de energia interna sempre será nula, ou seja, delta U = 0. A partir daí basta aplicar os dados na equação da energia interna : 2. Neste caso devemos usar a equação da energia interna juntamente com a equação de Clapeyron, assiTrabalho de um gás. Quando são colocados moles de um gás em um recipiente com êmbolo que.
No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero. Para um gás com n mols, a variação da energia interna total pode ser determinada em função da variação da temperatura do gás. Para essa determinação, usamos a seguinte expressão: Atente-se: a temperatura sempre deve. Energia Interna (U) Chamamos de energia interna a fração da energia total de um sistema física que é determinada apenas pelo seu estado e que corresponde a soma das energias cinética e potencial das partículas (átomos, moléculas) que compõe esse sistema. Como a energia interna de um gás ideal só depende da temperatura, e esta não varia, então a variação da energia interna ∆ U é igual a zero.
A energia recebida pelo gás na forma de calor. A entalpia H pode ser deduzida da aplicação da primeira lei, num processo a pressão constante. A utilização direta desses princípios em motores de combustão interna ou.
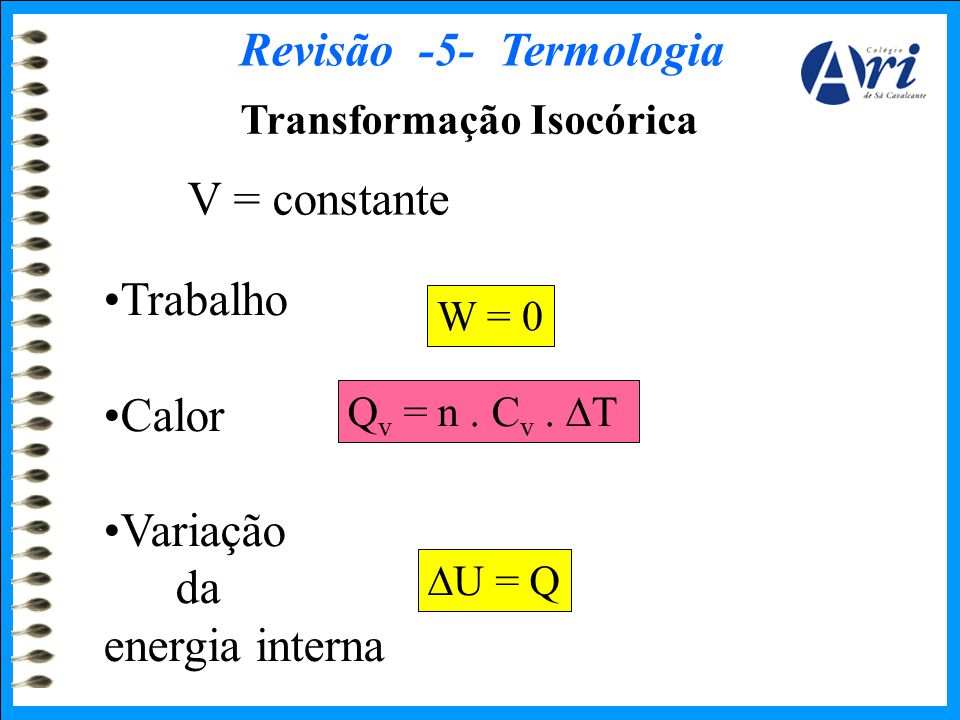
O trabalho será negativo e corresponde à área dentro da figura. Ela corresponde a soma da energia cinética (Ec), produzida pelo movimento dos corpos, com a energia potencial elástica (Epe) ou gravitacional (Epg), produzida por meio da interação dos corpos relacionada com a posição dos mesmos. Isso significa que a variação da energia interna sofrida pelo sistema gasoso tem valor igual ao do calor trocado com o meio externo. A primeira lei da Termodinâmica trata da conservação da energia. Em uma transformação isocórica, não haverá realização de trabalho.
J de calor são fornecidos a uma quantidade de ar. Lista de exercício (termodinâmica) 1. A temperatura está diretamente ligada à energia interna. Quanto maior a variação da energia interna , maior a temperatura! No caso como o pistão pode se mover, o gás pode realizar trabalho!
Quando o gás realiza trabalho, ele diminui a variação de energia interna , diminuindo assim o aumento de temperatura! Assim o que se faz é medir a variação de sua energia interna , ou seja, sabendo-se quanto um sistema cedeu de energia , seja na forma de calor ou de trabalho, e invocando a Lei da Conservação de Energia , somos capazes de precisar quanto da energia interna este sistema perdeu. Através de toda essa variação de temperatura, pressão e volume, a primeira lei da termodinâmica relata essa variação entre a energia interna de um sistema que pode ser expresso através de diferenças no calor trocado com um meio externo todo ele realizado, tornando essa transformação única.
Como T não varia, a energia cinética das moléculas também não varia. Em suma, a energia interna independe do volume se a temperatura é constante, pois ela só depende da temperatura. Portanto, a energia interna não varia, mesmo que o volume varie.
Conforme a primeira lei da Termodinâmica quando realizamos um trabalho sobre o gás, comprimindo-o, ou se cedemos calor ao gás, ele recebe energia que conserva como energia interna. Calcule o calor específico molar a volume constante. Qual a variação na energia interna do gás? O sistema trocou calor com o meio ambiente. Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente.
A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão. Considerando cal= 4J calcule a quantidade de energia transferida ao sistema, em joules. Utilizando a primeira lei da termodinâmica,calcule a variação de energia interna desse sistema.
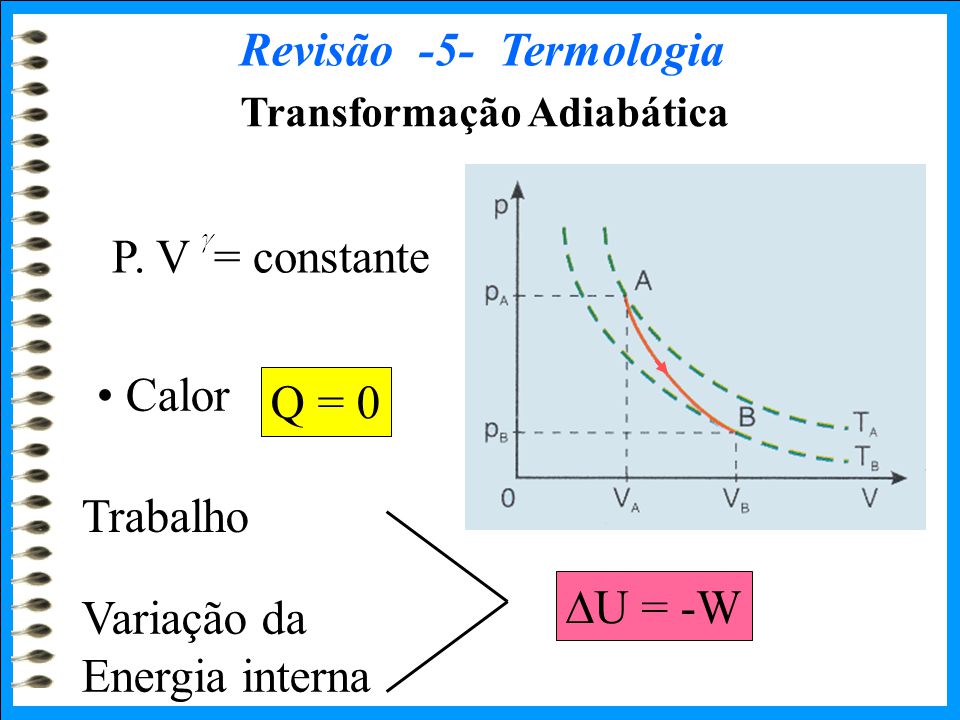
O gráfico da figura representa uma transformação sofrida por uma determinada massa de gás perfeito.