Com esses dados podemos determinar a variação da energia interna , que será: ΔU = 4. U = 37J Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás. Aula – Energia Interna e Trabalho do gás – Duration: 12:36. Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre. Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho.
No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero. Para um gás com n mols, a variação da energia interna total pode ser determinada em função da variação da temperatura do gás. Para essa determinação, usamos a seguinte expressão: Atente-se: a temperatura sempre deve. A variação da energia interna do gás.
Como a energia interna de um gás ideal só depende da temperatura, e esta não varia, então a variação da energia interna ∆ U é igual a zero. A energia recebida pelo gás na forma de calor. Variação da energia interna em termos da variação de volume do gás. Energia interna para gases diatômicos Para os gases diatômicos ideais, a energia interna é dada por uma equação um.
O referencial para medida da energia interna é sempre assumido como estático em relação ao centro de massa do sistema em questão. Energias oriundas de interações entre alguma parte do sistema e quaisquer partes pertencentes à vizinhança do sistema não são incluídas na apuração da energia interna do sistema. A partir das afirmações acima, podemos concluir que, a energia interna de certo número de mols de um gás perfeito, é totalmente dependente da temperatura, e que a energia interna de um determinado número de mols de um gás perfeito, é diretamente proporcional à temperatura absoluta do gás. A figura ao lado mostra um ciclo fechado de um gás (a figura não está desenhada em escala). Quando o gás passa de c para d recebe 1J na forma de calor.
Há duas formas de se fazer a energia interna de um sistema fechado variar: via calor, e via trabalho. A 1ª Lei da termodinâmica estabelece que a variação da energia interna ( ) de um sistema corresponde à energia térmica (Q) recebida pelo sistema na forma de calor menos a energia cedida pelo sistema à sua vizinhança na forma de trabalho (W). Portanto, toda energia recebida ou cedida pelo sistema ocorre por meio de trabalho.
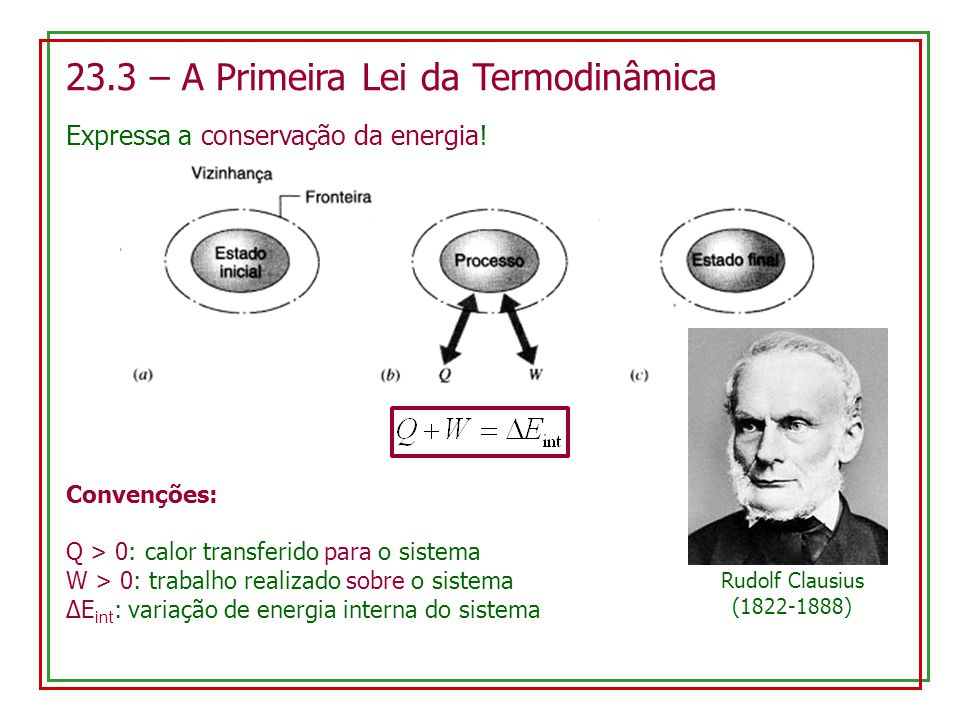
Isso significa que a variação da energia interna sofrida pelo gás é igual ao trabalho que o sistema troca com o meio ambiente. Complete a tabela com os valores do calor absorvido pelo gás (Q), da variação da sua energia interna (ΔU) e do trabalho realizado pelo gás (W), medidos em Joule, em cada um dos trechos AB, BC, CD e DA , representados no diagrama PV. Ou seja, todo o trabalho associado ao gás é transformado em energia interna.
Mas note que o sinal de menos nos leva a uma conclusão: – Se o gás é comprimido, o trabalho é negativo. Um gás ideal sofre uma transformação:absorve 50cal de energia na forma de calor e expandese realizando um trabalho de 300J. A temperatura de mols de um gás ideal monoatômico é aumentada para 15K a volume constante. Quais são (a) o trabalho W realizado pelo gás , (b) a energia transferida como calor Q, (c) a variação Eint da energia interna do gás e (d) a variação K da energia cinética média por átomo? Essa grandeza está relacionada com a variação da temperatura e da energia cinética das partículas.
Um gás ideal, formado por apenas um tipo de átomo, possui energia interna diretamente. Imagine um sistema com um gás em um embolo hermeticamente fechado. J e 125J 6- Um litro de agua entra em ebulição a 100℃, sob pressão constante, a agua transforma-se totalmente em vapor, passando a ocupar o volume de cerca 6×〖10〗^litros.
Suponha que o oxigénio possa ser tratado como um gás ideal. O significado de trabalho na termodinâmica e como calcular o trabalho realizado pela compressão ou expansão de um gás. Em uma transformação adiabática, o trabalho será realizado sobre gás quando a variação da energia interna é positiva. Dessa maneira, em uma transformação, a variação da energia interna ΔU do sistema depende do calor Q trocado e do trabalho τ na transformação. Essa conclusão decorre da Lei de Joule segundo a qual quando um gás se expande sem realizar trabalho (por exemplo, para dentro de câmara evacuada) e sem receber ou dar calor, a temperatura do gás não muda (para gás ideal).
Neste caso, dW = dq = e então du = 0. Como T não varia, a energia cinética das moléculas também não varia. As temperaturas inicial e final do gás. A quantidade de calor trocada pelo gás na transformação de A para B. Compressão isotérmica do gás até atingir uma pressão P2. Na transformação, a densidade do gás é diretamente proporcional à pressão. O sistema trocou calor com o meio ambiente.
Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente. Correta – na transformação isotérmica, a temperatura do sistema é constante, portanto a variação da energia interna é nula.