Quando houver aumento da temperatura absoluta ocorrerá uma variação positiva da energia interna. Quando houver diminuição da temperatura absoluta, há uma variação negativa de energia interna. E quando não houver variação na temperatura do gás, a variação da energia interna será igual a zero.
Com esses dados podemos determinar a variação da energia interna , que será: ΔU = 4. U = 37J Temos que ficar atentos ao fato de a energia interna ser sempre uma grandeza positiva, pois esta é diretamente proporcional à temperatura absoluta do gás. ENERGIA INTERNA DOS GASES (U) – TERMOLOGIA – Aula – Prof. Assim para concluir podemos dizer que a energia interna de um gás depende diretamente da variação de temperatura que este gás sofre.
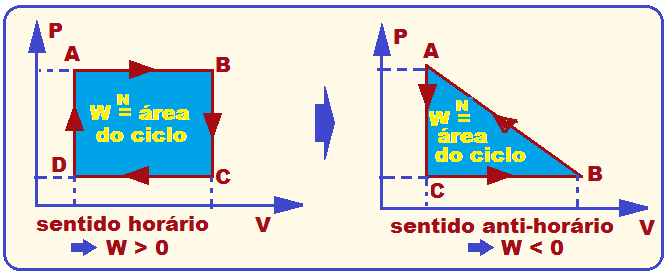
Como a variação de energia interna não depende da variação de pressão ou de volume, podemos dizer que em um gráfico de P por V ela não dependerá do caminho. Assim, podemos dizer que a energia interna de um sistema varia diretamente com a temperatura. Exceto nas mudanças de estado. A variação de energia interna é independente dos estados intermediários. Importante: Em um ciclo, a variação de energia interna sempre será nula, ou seja, delta U = 0. Variação da energia interna em termos da variação de volume do gás.
Energia interna para gases diatômicos Para os gases diatômicos ideais, a energia interna é dada por uma equação um. E continua a ocorrer enquanto houver diferença entre as temperaturas, isto é, até se alcançar o equilíbrio térmico. Ou seja, todo o trabalho associado ao gás é transformado em energia interna. Mas note que o sinal de menos nos leva a uma conclusão: – Se o gás é comprimido, o trabalho é negativo.
UEL-PR) – Fornecem-se calorias de energia sob forma de calor a um sistema termodinâmico, enquanto se realiza sobre ele trabalho de joules. Podemos admitir, então, que toda substância possui quantidade de energia interna armazenada em seu interior, como energia química (forças de coesão entre as moléculas, nas ligações entre átomos) ou energia térmica (nos movimentos de translação, rotação e vibração de moléculas). Assim H será também uma função de estado. Através de toda essa variação de temperatura, pressão e volume, a primeira lei da termodinâmica relata essa variação entre a energia interna de um sistema que pode ser expresso através de diferenças no calor trocado com um meio externo todo ele realizado, tornando essa transformação única. Agora considere o fornecimento de uma determinada quantidade de calor q ao sistema, que realizará um trabalho τ sobre o meio ambiente.
Há duas formas de se fazer a energia interna de um sistema fechado variar: via calor, e via trabalho. A 1º Lei da termodinâmica estabelece que a variação da energia interna ( ) de um sistema corresponde à energia térmica (Q) recebida pelo sistema na forma de calor menos a energia cedida pelo sistema à sua vizinhança na forma de. Trabalho de um gás sob pressão constante. Ela corresponde a soma da energia cinética (Ec), produzida pelo movimento dos corpos, com a energia potencial elástica (Epe) ou gravitacional (Epg), produzida por meio da interação dos corpos relacionada com a posição dos mesmos. Difere da variação da energia interna , uma vez que, para uma determinada pressão constante não nula, quando ocorre uma transformação física (ex. sólido para líquido ou líquido para sólido) há uma variação do volume do sistema, a que está associado um trabalho.
Parte do calor (Q) recebido pelo sistema é armazenada sob forma de energia interna e parte é transformada em trabalho, de modo que ΔU = Q – W. Assim o que se faz é medir a variação de sua energia interna , ou seja, sabendo-se quanto um sistema cedeu de energia , seja na forma de calor ou de trabalho, e invocando a Lei da Conservação de Energia , somos capazes de precisar quanto da energia interna este sistema perdeu. No entanto, a variação da energia interna pode assumir valores positivos, negativos ou até mesmo ser igual a zero. Para um gás com n mols, a variação da energia interna total pode ser determinada em função da variação da temperatura do gás. Para essa determinação, usamos a seguinte expressão: Atente-se: a temperatura sempre deve. Quando a energia interna total dos reagentes ( energia inicial) for maior do que a energia interna total dos produtos formados ( energia final ), a reação irá liberar energia ( reação exotérmica ), ou seja, libera energia.
O sistema trocou calor com o meio ambiente. A energia interna permaneceu constante. Como a temperatura permaneceu constante, o sistema não trocou calor com o meio ambiente. A quantidade de calor recebida é igual ao trabalho realizado pelo gás na expansão.
Exemplo – A Energia Interna de um líquido ou gás. Artigo – O Principia de Isaac Newton. Exercício – O pulo do gato de Schrödinger.

Como já vimos nas aulas anteriores, uma característica de um gás ideal é ter a energia total constante, com q = -w, numa expansão isotérmica. Essa grandeza está relacionada com a variação da temperatura e da energia cinética das partículas. Quando ocorre uma variação da energia interna de um corpo ao ser colocado em contato com outro, exclusivamente porque há diferença de temperatura entre ambos. E por isso dizemos que a energia interna é uma função de estado, ou seja, depende apenas do estado inicial e final para ser caracterizada não importando o caminho. A parcela de energia interna de um sistema em seu equilíbrio termodinâmico que não pode mais ser convertida em trabalho à temperatura de equilíbrio pode ser determinada pelo produto da entropia S pela temperatura absoluta T do sistema no respectivo estado, encontrando-se disponível à execução de trabalho por tal apenas a parcela.
No decorrer da reação observamos que a capacidade de realização de trabalho útil vai gradativamente diminuindo, com o consumo dos reagentes e formação de produto deste modo o sistema atinge o equilíbrio dinâmico. Explore a pasta Energia interna de Felipe Muniz no Pinterest. Veja mais ideias sobre Psychedelic, Sacred art e Sacred Geometry. Qual a variação na energia interna do gás? Calcule o calor específico molar a volume constante.
Pessoal, não consegui calcular essa variação de energia interna e de entropia, será que alguém pode me ajudar?