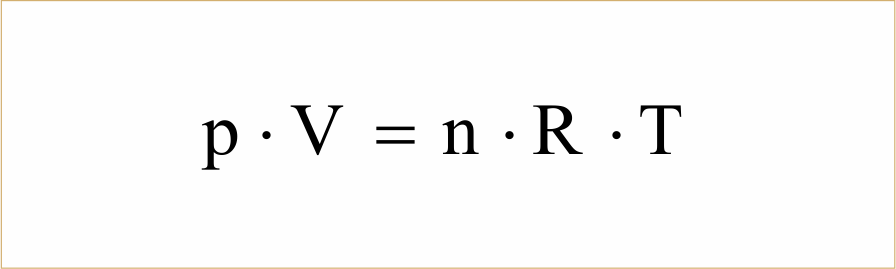
Esta equação de estado possibilita descrever o comportamento de um gás ideal, com base no conhecimento da sua pressão, volume ou temperatura. Um gás ideal é constituído por partículas sem volume e onde não existem forças de interacção entre elas, e por isso, o conceito de gás ideal é uma aproximação de um gás real. Observe que essa equação relaciona as três variáveis de estado dos gases (pressão (P), volume (V) e temperatura (T)) para uma quantidade “n” de mols de partículas de um gás , descrevendo, desse modo, o comportamento de um gás ideal. Mas como se chegou a essa equação ? Série: Estudo dos gases (EG) Hoje mostramos nesta aula como a equação do gás ideal foi desenvolvida a partir da equação geral dos gases.
Dentro de um contentor cilíndrico, que possui um êmbolo móvel, aprisiona-se uma certa quantidade de gás. Essa é conhecida como a equação geral dos gases, que aborda as três variáveis de estado (P, V e T). Um objeto prático que nos ajuda a entender a aplicação deste princípio: as latas de aerossóis. Qualquer equação que apresente uma relação entre as variáveis de estado de um gás é denominada equação de estado do gás. A equação cúbica de estado reduzida resulta neste caso soluções.
Quanto aos gases, é CORRETO afirmar que: a) sob pressão de uma atmosfera e temperatura ambiente, um mol de qualquer gás ocupa o volume de 2litros. Quando estudamos um gás , temos que estudar suas três grandezas fundamentais: pressão, volume e temperatura. Essas grandezas são chamadas de variáveis de estado dos gases porque elas influenciam grandemente suas propriedades e comportamento. Prove que a soma das frações molares de uma mistura gasosa é igual a 1. Exercícios sobre equaÇão de estado de um gás (clapeyron) e misturas gasosas 01.

Defina a pressão parcial de um gás. A Lei dos Gases Ideais relaciona as variáveis de estado : temperatura, pressão, volume e número de mols, o que permite determinar o valor de uma variável quando se. As transformações gasosas são aquelas em que se considera uma determinada massa fixa de um gás ideal em um sistema fechado para observar como as variáveis de estado dos gases (pressão, volume e temperatura) inter-relacionam-se. Esse processo é feito por manter constante uma dessas variáveis, enquanto se observa como ocorre a variação das outras duas. Nessa equação vemos que o fator de compressibilidade é, como definido na linguagem da metrologia, um fator de correção para a equação dos gases ideais.
Relacionando as Leis de Boyle, Charles Gay-Lussac e de Charles é possível estabelecer uma equação que relacione as variáveis de estado : pressão (p), volume (V) e temperatura absoluta (T) de um gás. Cuidado: gás ideal é uma substância idealizada! Os gases reais se comportam como gás ideal a baixas pressões e altas temperaturas. Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e. De seguida, apresenta-se a dedução da equação de estado de um gás ideal. Transformações de um gás : com temperatura constante e com pressão constante.
No caso de um gás perfeito , a pressão total exercida por uma mistura é igual à soma das pressões parciais dos componentes. Dalton , conseqüência da equação dos gases perfeitos , para qual o estado do gás depende só do número de moléculas e não da sua natureza. Apesar de existirem hoje diversas equações de estado , a formulação de van der Waals é particularmente importante porque atribui sentido físico às correções, além disso ajustando sua equação a dados. O físico parisiense, Benoit Pierre Emile Clapeyron, estabeleceu uma equação que relaciona as três variáveis de estado de um gás , ou seja, pressão (p), temperatura (T) e volume (V) para uma quantidade de matéria igual a n, descrevendo totalmente o comportamento de um gás ideal. Um gás real aproxima-se do comportamento de um gás ideal à medida que diminui a pressão e aumenta a temperatura.
Assim, pode-se escrever a equação de estado como: que é denominada equação de estado de Clausius. Equação de estado dos gases ( Equação de Clapeyron) – Brasil Escola. Na equação de Clapeyron (pV = nRT), o valor de R depende das unidades de pressão e volume.

Numa transformação de estado de um gás , a pressão sempre aumenta com o aumento de volume. A baixas pressoes e altas temperaturas todos os gases reais tendem para um mesmo comportamento, o qual, para o seu estudo, é aproximado por um modelo, o chamado de “ Gas Ideal”. O estado do gas é descrito por varios parámetros, que são: o volume, v, a pressão, p, a temperatura, T, e a quantidade de substância (número de moles), n. FAAP) Numa embalagem plástica de volume litros, que pode suportar uma pressão interna de até atm, foi embalado a vácuo um sólido que ocupa o espaço de litro. Exercício resolvido – equação geral dos gases) Uma dada massa de gás perfeito está em um recipiente de volume litros, a temperatura de o C, exercendo a pressão de atm. Reduzindo-se o volume a litros e aquecendo-se o gás , a sua pressão passou a ser deatm.
Determine a que temperatura o gás foi aquecido. A Lei dos Gases Ideais é uma equação de estado que descreve a resposta de um gás ideal a mudanças de pressão, volume, temperatura e quantidade de moléculas. Entretanto, diversos processos industriais empregam determinadas condições de pressão e temperatura, as quais a lei dos gases ideais não são exatamente obedecidas.
As equações de estado da maioria das substâncias não são conhecidas, entretanto certas equações de estado são.